
科目: 来源:不详 题型:问答题
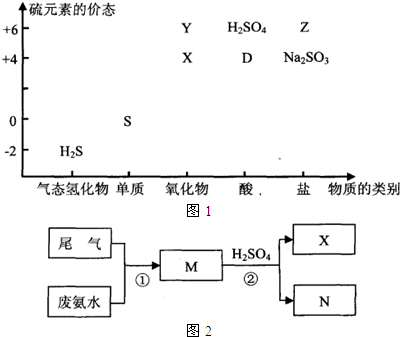
| ||
| H+ |
查看答案和解析>>
科目: 来源:杭州一模 题型:单选题
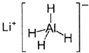
| A.LiH与D2O反应,所得氢气的摩尔质量为4g?mol-1 |
| B.1 mol LiAlH4在125℃完全分解,转移3 mol 电子 |
| C.标准状况下,1 mol LiAlH4跟足量水反应可生成89.6L氢气 |
| D.LiAlH4与乙醛反应可生成乙醇,其中LiAlH4作还原剂 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Li2NH中N的化合价为-1 |
| B.此法储氢和钢瓶储氢的原理相同 |
| C.LiH中的阳离子半径大于阴离子半径 |
| D.该反应中H2既是氧化剂又是还原剂 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.NH3 | B.CO | C.CH3CH2OH | D.H2O2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Ca2+、Al3+、SO42-、Cl- | B.K+、Na+、SO32-、NO3- |
| C.Na+、K+、NO3-、SO42- | D.NH4+、Na+、Cl-、CO32 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.+2 | B.-2 | C.-1 | D.0 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Na2O2在反应中只作氧化剂 |
| B.FeSO4在反应中作氧化剂 |
| C.2molFeSO4发生反应时,反应中共有8mol电子转移 |
| D.Na2FeO4既是氧化产物又是还原产物 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com