
科目: 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:实验题
(14分)某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
|
实验 |
药品 |
制取气体 |
量气管中的液体 |
|
Ⅰ |
Cu、稀HNO3 |
|
H2O |
|
Ⅱ |
NaOH固体、浓氨水 |
NH3 |
|
|
Ⅲ |
Na2SO3固体、浓H2SO4[来 |
SO2 |
|
|
Ⅳ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |
⑴实验过程中,使用分液漏斗滴加液体的操作是 。
⑵该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行? (填“可行”或“不可行”),原因是 .
⑶实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中,现象是 .发生反应的离子方程式是 .
⑷实验Ⅱ中量气管中的液体最好是____(填字母编号,下同)
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有 .
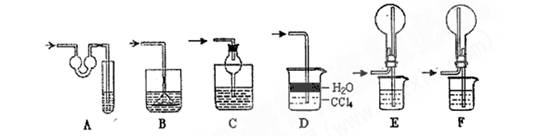
⑸本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,② ,③视线与凹液面最低处相平.
⑹实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
|
编号 |
镁铝合金度量 |
量气管第一次读数 |
量气管第二次读数 |
|
① |
1.0g |
10.0mL |
346.3mL |
|
② |
1.0g |
10.0mL |
335.0mL |
|
③ |
1.0g |
10.0mL |
345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为__ __.
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:填空题
(14分)D、E为中学化学常见的金属单质,在一定条件下C、D间能发生反应.各物质转化关系如下图:
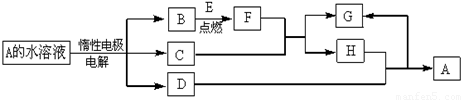
⑴B的同素异形体的名称为:_____________;H的化学式为:_____________.
⑵写出D与H反应的离子方程式__________ ___.
⑶用惰性电极电解A 溶液的阳极反应式为:_____________ .
⑷检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________.
a.氯水和KSCN溶液 b.氢氧化钠溶液 c.酸性KMnO4溶液
⑸用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8 g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH.则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________.
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:填空题
(15分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
⑴常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是 .
⑵A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 .
⑶A、B、D、E四种元素组成的某无机化合物浓度为0.1 mol/L时,pH最接近 .
A.5.6 B.7.0 C.8.4 D.13.0
⑷在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=________;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.理由是
.
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65 kJ
的热量.写出该反应的热化学方程式 .
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:实验题海水资源
(15分)
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:

⑴请列举海水淡化的两种方法 、 。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 .
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: .
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
.
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:填空题
(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
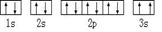 ⑶某同学根据上述信息,推断C基态原子的核外电子排布为:
⑶某同学根据上述信息,推断C基态原子的核外电子排布为:
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型
为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .
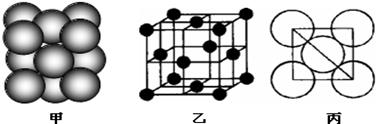
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:填空题
(15分)
已知G是合成某高分子化合物的原料,只含C、H、O三种元素,5.9g物质G能与1mol/LNaOH的溶液100mL恰好完全反应,0.1mol物质G与足量金属钠反应在标准状况下生成2.24L氢气,分子结构中含有一个甲基,A的分子式为C8H13O2Br,有机物A、B、C、D、E、F、G之间的相互转化关系如图所示:

⑴写出C的结构简式: .
⑵A中官能团名称是: .
⑶B的同分异构体中属于酯的有多种,任写其中三种属于酯类的结构简式 :
, , .
⑷写出D→E化学反应方程式: .
⑸写出反应①化学反应方程式:
⑹写出由F和G 在一定条件下合成高分子化合物的化学反应方程式:
.
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三第六次模拟考试(理综)化学部分 题型:选择题
生活中的某些问题,常涉及到化学知识,下列分析不正确的是 ( )
A.冰箱中使用的含氟制冷剂泄漏后,会破坏臭氧层
B.Cl2和SO2都有漂白作用,都可以使有色棉布褪色
C.减少硫的氧化物和氮氧化物向空气中的排放,是防止酸雨形成的有效措施
D.严格地讲实验室使用排风扇是种不负责任的防污染手段,因为产生的有害气体没有得到转化或吸收
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三第六次模拟考试(理综)化学部分 题型:选择题
NA表示阿伏加德罗常数的值,则下列叙述正确的是 ( )
A.6.8g熔融的KHSO4中含有0.1NA个阳离子
B.1 L 0.5mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
C.25℃时,1 L pH=13的NaOH溶液中约含有NA个氢氧根离子
D.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三第六次模拟考试(理综)化学部分 题型:选择题
下列说法正确的是( )
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;
c(NH4+) 由大到小的顺序是:①>②>③>④
B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c (Na+) +c(H+) = c (S2―) +c (HS―)+c (OH―)
D.AgCl悬浊液中存在平衡: AgCl(s) 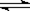 Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省高三第六次模拟考试(理综)化学部分 题型:选择题
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的( )
A.肯定有A13+、Mg2+、NH4+、Cl— B.肯定有Al3+、Mg2+、HCO3—
C.肯定有K+、HCO3—、MnO4— D.肯定有A13+、Mg2+、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com