
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:选择题
a、b、c、d分别是Cu、Ag、Fe、Al四种金属中的一种,已知:(1)b、c用导线相连插入稀硫酸溶液中,b表面上有气泡产生;(2)b与d的硝酸盐反应能置换出单质d;(3)a与强碱反应放出气体。由此可判断a、b、c、d依次为 ( )
A.Fe、Ag、Al、Cu、 B.Al、Fe 、Cu、Ag
C.Al、Cu、Fe、Ag D.Fe、Ag、Cu、Al
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:选择题
为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A. KI(淀粉溶液) B. Na2SO3溶液(BaCl2溶液)
C. FeCl2溶液(KSCN溶液) D. NaOH溶液(HCl溶液)
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:选择题
下列溶液中各微粒的浓度关系正确的是 ( )
A.物质的量浓度相等的① (NH4)2SO4、②NH4HSO4、③NH4Cl溶液中c(NH4+): ① > ②> ③
B.醋酸钠与醋酸混合而成的酸性溶液: c(Na+)>c(CH3COO-)>c(H+) > c(OH-)
C.0.1mol/L NH4Cl溶液:c(NH4+)>c(Cl-) >c(OH-) >c(H+)
D.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-)
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:选择题
以氢气、一氧化碳为主要成分,供化学合成的一种原料气体叫合成气。工业上通过“天然气蒸气转化”反应来得到合成气,其反应为:CH4+H2O(g) CO+3H2;△H>0。工业上通过采用合适的温度和压强、适宜的催化剂以及合适的CH4与H2O配比来获得最佳的生产效率。对于该转化反应的有关叙述正确的是( )
CO+3H2;△H>0。工业上通过采用合适的温度和压强、适宜的催化剂以及合适的CH4与H2O配比来获得最佳的生产效率。对于该转化反应的有关叙述正确的是( )
A.增大压强,有利于得到更多的合成气
B.反应温度越低,越有利于合成气的生产
C.工业生产中采用加入过量水蒸气来提高甲烷的利用率
D.工业生产中使用催化剂的目的在于提高甲烷的利用率
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:选择题
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于某一反应中的反应物和生成物。下列叙述不正确的是 ( )
A. 该反应一定为氧化还原反应
B. 若NH4+为产物,则Fe3+也是产物
C. 该反应过程中,溶液的pH不断增大
D. 该反应的离子方程式中,Fe2+、NH4+两者计量数之比为1:8
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:选择题
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是 ( )

A. 只用盐酸一种试剂就可以确定该固体M的具体成分
B. 往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C. 用pH试纸检验,若pH=7,则固体M一定是Na2SO4
D. 往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:填空题
近期市场上出现一种无需火电,无需热水的自热米饭。自热米饭饭盒中有发热包,发热包中有一小包粉末及少量液体(水)。根据要求回答问题:
(1)对发热包中粉末的成分,甲在查阅资料的基础上,认为可能含有镁粉、铁粉、碳粉、氯化钠固体等物质,并通过下述实验来检验:
①将磁铁放置于粉末中,部分固体被吸引,说明粉末中含 ;
②取①未被磁铁吸引的粉末用水溶解,过滤。往滤液中滴入硝酸银溶液,有白色沉淀,说明粉末含有 ;
③取步骤②的不溶物,滴加稀硫酸直至过量,过滤,得到黑色固体,说明发热包中含有;
④取步骤③滤液并加入足量氢氧化钠溶液,出现白色沉淀,说明发热包中有 。
(2)甲注意到说明书上的提示:使用时,操作控件使发热包中的粉末与液体混合而放热。放热过程分两个阶段:第一阶段,较短的时间内产生大量的热,使饭煮熟;第二阶段,持续温和地放热,达到保温的目的。据此,他认为饭盒工作时应有两个原电池反应发生。
快速发热时负极反应式为 ,
保温时正极电极反应式 。
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:填空题
部分短周期元素的原子半径及常见化合价如下表:
|
元素代号 |
Z |
M |
Q |
R |
T |
X |
|
原子半径/nm |
0.077 |
0.130 |
0.111 |
0.099 |
0.073 |
0.102 |
|
常见化合价 |
+4 ,-4 |
+2 |
+4 ,-4 |
-1,+7 |
-2 |
+6,-2 |
根据要求回答问题(如需填化学用语的,请用各元素的元素符号表示)
(1) X元素在元素周期表的位置是 。
(2) R的气态氢化物比X的气态氢化物 (填稳定或不稳定)。
(3)写出M的单质与ZT2反应的化学方程式 。
(4)Q的最高价氧化物在现代通信的重要用途是 。
(5)己知XO2在500℃,1大气压下被氧气氧化,每生成1 mol气态XO3,放出98.3 kJ热量,该反应的热化学方程式是
(6)工业上用Z的单质与水蒸汽反应制水煤气,则该反应的平衡常数表达式K= 。
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:填空题
室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
|
实验 编号 |
I—的初始浓度 (mol·L-1) |
OCl—的初始浓度 (mol·L-1) |
OH—的初始浓度 (mol·L-1) |
初始速率v (mol·L-1· s-1) |
|
1 |
2 × 10–3 |
1.5 × 10–3 |
1.00 |
1.8 × 10–4 |
|
2 |
a |
1.5 × 10–3 |
1.00 |
3.6 × 10–4 |
|
3 |
2 × 10–3 |
3 × 10–3 |
2.00 |
1.8 × 10–4 |
|
4 |
4 × 10–3 |
3 × 10–3 |
1.00 |
7.2× 10–4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I—]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为 ;
(2)实验2中,a= ;
(3)设计实验2和实验4的目的是 ;
(4)计算b、c值:b= ;c= ;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
查看答案和解析>>
科目: 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:填空题
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
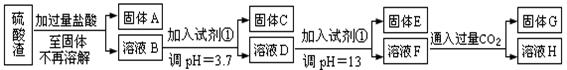
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= ( 25℃时,氢氧化镁的Ksp=5.6×10-12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com