
科目: 来源:2010-2011学年浙江省高三高考全真模拟卷(理综)化学试题 题型:填空题
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为: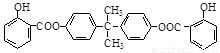
BAD的合成路线如下:
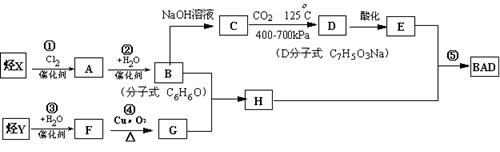
试回答:
(1)写出结构简式Y ________________________ D____________________。
(2)属于取代反应的有_____________________________(填数字序号) 。
(3)1molBAD最多可与含____mol NaOH的溶液完全反应
(4)写出反应④方程式_______________________________________________
(5)写出B+G→H方程式________________________________________________。
(6)E的同分异构体有下列性质:①与FeCl3反应,溶液呈紫色;;②能发生银镜反应,则该同分异构体共有 种。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:选择题
3月11日的日本大地震使福岛第一核电站受损,泄漏放射性物质131I、132I、和134Cs、137Cs等导致核污染。服用一定剂量的碘片可防放射性碘的伤害。被污染的水用硅酸钠来处理。下列说法错误的是
 A.131I、132I、134Cs、137Cs是四种不同的核素
A.131I、132I、134Cs、137Cs是四种不同的核素
B.食用碘盐不能防辐射
 C.碘片的主要成分是I2
C.碘片的主要成分是I2
D.用硅酸钠溶液处理污染水,主要利用该溶液具有的粘合性
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:选择题
关于阿伏加德罗常数(用NA表示)的下列叙述完全正确的是
A.1mol羟基(—OH)与17gNH3所含电子数都为NA
B.12.4g白磷(分子式为P4)中含有P-P共价键0.4 NA
C.由铜锌硫酸原电池中,当Cu极生成2.24LH2,则电路通过电子一定为0.2NA
D.将足量的铜屑加入到浓度均为2mol·L-1的HNO3和H2SO4的混合溶液100mL中,充分反应后,转移的电子数为0.45NA
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:选择题
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
A.酒精的燃烧热为Q3 kJ
B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:选择题
下列溶液中微粒的物质的量关系正确的是
A.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4)
B.①0.2mol/LNH4Cl溶液、②0.1mol/L (NH4)2 Fe(SO4)2溶液、③0.2mol/LNH4HSO4溶液
④ 0.1mol/L(NH4)2 CO3溶液中,c(NH4+)大小:③>②>①>④
C.0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:
c(Cl-)>c(H+)>c(Na+)> c(CH3COO-)>c(OH-)
D.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-)
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:选择题
有研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4·H3PO4,分子结构如图,是一种纳米级药物,下列有关奥司他韦的说法中正确的是
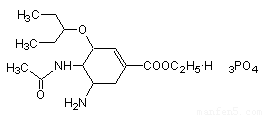
A.只含极性键,易溶于水,其水溶液有丁达尔效应
B.分子中只含有酯基、氨基、肽键三种官能团
C.1mol 该物质最多能与4molNaOH反应
D.可以发生加成、取代、氧化反应
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:选择题
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池反应通常 表示为
LaNi5H6+6NiO(OH)==LaNi5+6Ni(OH)2。下列说法正确的是
A.放电时储氢合金作正极
B.放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+
C.充电时阳极周围c (OH-)减小
D.充电时储氢合金作负极
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:填空题
中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1∶4。请回答:
⑴若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是 。
⑵若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 。
⑶若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是 。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol。
⑷若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应后,溶液中离子浓度从大到小的顺序是 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三高考全真压轴考试(理综)化学试题 题型:填空题
已知2A(g)+B(g)  2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>” “=”或“<”)。
|
T/K |
T1 |
T2 |
T3 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C 的浓度 (填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A.4molA和2molB B.4molA、2molB和2molC
C.4molA和4molB D.6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出C气体 B.适当升高温度
C.增大B的浓度 D.选择高效催化剂
⑸若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”),理由是 。
⑹在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量 (填“不变”“变大”“变小”或“无法确定”)。
⑺某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小。已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。下列说法错误的是

A.A线是AgCl,C线是AgI
B.e点表示由过量的KI与AgNO3反应产生AgI沉淀
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.B线一定是AgBr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com