
科目: 来源:2010-2011学年浙江省杭州市高三第二次质检(理综)化学部分 题型:选择题
常温熔融盐又称常温离子液体(ionic liquid),1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕,其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.该离子液体中含的氨分子
B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++2H2O C2H5NH2·H2O+H3O+
C2H5NH2·H2O+H3O+
D.同温度下相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH小
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三第二次质检(理综)化学部分 题型:填空题
(14分)
I.有A、B、C、D四种短周期元素,其中A、D同主族;又已知B和A可形成组成为BA的化合物,其中A的化合价为-1,B和C可形成组成为B2C2的化合物,A、B、C形成的单核离子的核外电子总数相同。
(1)元素A在周期表中的位置是 。
(2)B、C、D可形成组成为BDC的化合物,该化合物水溶液中通入过量CO2发生反应的离子方程式为 。
(3)B2C2在酸性条件下可形成具有二元弱酸性质的物质,该弱酸性物质和B的最高价氧化物对应水化物反应时可生成一种酸式盐,该酸式盐的电子式为 。
II.长期以来一直认为氟的含氧酸不存在。但是自1971年斯图杰尔和阿佩里曼(美)成功地合成了次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。已知次氟酸的分子构成与次氯酸相仿。
⑴次氟酸中氧元素的化合价为 。
⑵下面给出了几个分子和基团化学键的键能(E):
|
|
H2 |
O2 |
F2 |
O-H |
O-F |
H-F |
|
E/(kJ/mol) |
432 |
494 |
155 |
424 |
220 |
566 |
请计算反应:2HFO=2HF+O2的反应热(△H)的近似值为 kJ/mol。
⑶次氟酸刹那间能被热水所分解,生成一种常见的物质H2O2,写出次氟酸与热水反应的化学方程式: 。
(4)1986年,化学家Karl Christe首次用2K2MnF6 + 4SbF5 === 4KSbF6 + 2MnF3 + F2↑化学方法制得了F2。该反应中被还原的元素化合价从 价变为 价,若反应中生成标准状况下11.2 L的F2,则有 mol电子发生转移。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三第二次质检(理综)化学部分 题型:填空题
(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
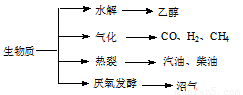
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
|
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
|
平衡常数 |
K1 |
K2 |
K3 |
|
反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g)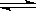 CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
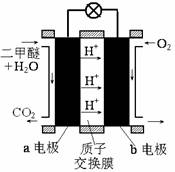
b电极是 极;a电极的反应式为 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三第二次质检(理综)化学部分 题型:实验题
(15分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ;
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。

(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三第二次质检(理综)化学部分 题型:填空题
(14分)高分子材料M在光聚合物和金属涂料方面有重要用途,M的结构简式为:

工业上合成M的过程可表示如下:
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填序号字母)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D在水中的溶解性很大,遇新制Cu(OH)2悬浊液, 溶液呈绛蓝色
d.E→M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式: ,该反应类型是 反应。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系:

写出F、N的结构简式F: N: 。
写出反应①的化学方程式 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三上学期第三次月考化学试卷 题型:选择题
诺贝尔化学奖获得者Gerhard Ertl在表面化学研究领域取得了开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
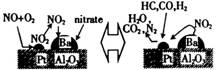
A. 汽车尾气催化转化机理
B. 钢铁生锈机理
C. 合成氨工业催化机理
D. 氢氧燃烧电池电极反应机理
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三上学期第三次月考化学试卷 题型:选择题
下列有关化学研究的正确说法是( )
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应热是相同的
C.依据丁达尔效应可将分散系分为溶液、胶体与浊液
D.从HF、HCI、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三上学期第三次月考化学试卷 题型:选择题
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率七彩教育网yjw
C.应用热化学方程有关计算规律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)== 2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三上学期第三次月考化学试卷 题型:选择题
下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应 HCO3-+ Ca2+ + OH- = CaCO3↓ + H2O
B.铁溶于稀硝酸,溶液变黄: Fe+4H++ NO3-=== Fe3++ NO↑+2H2O
C.Na2CO3溶液显碱性:CO32-+H2O=== HCO3-+OH-
D.已知稀溶液中,酸碱反应的中和热为57.3KJ/mol,则将浓度均为0.1mol/l的NaOH溶液与醋酸等体积混合时的热化学方程式为:
NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol
查看答案和解析>>
科目: 来源:2010-2011学年浙江省杭州市高三上学期第三次月考化学试卷 题型:选择题
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是 ( )
A.1L 1mol·L-1 CH3COOH溶液中,CH3COOH分子数约为6.02×1023
B.1molCl2与一定量的Fe刚好完全反应电子转移数约等于3×6.02×1023
C.在含4mol硅氧键的水晶晶体中,氧原子数目为2×6.02×1023七彩教育网yjw
D.用铁作电极电解饱和K2SO4溶液时,当阴极产生的气体体积为2.24L时,阳极产物的物质的量一定为0.05×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com