
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.氧化剂与还原剂的物质的量之比为1︰8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.若有l mol NO3-发生还原反应,则转移8mol e-
D.若把该反应设计为原电池,则正极反应为Fe2+-e-=Fe3+
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道的第一种离子液体硝酸乙基铵[(C2H5NH3)NO3]的熔点为12℃。已知C2H5NH2的化学性质与NH3相似,下列有关硝酸乙基铵的说法中,正确的是
A. 该离子液体可以作为电池的电解质
B. 硝酸乙基铵水溶液呈碱性
C. (C2H5NH3)NO3能与NaOH反应产生NH3
D. 硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++H2O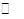 C2H5NH2+H3O+
C2H5NH2+H3O+
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
极细的黄金粒子在水中可以形成玫瑰红色胶体金,为了能观察到胶体金颗粒的形态,德国化学家席格蒙迪研制出超显微镜,创立了现代胶体化学研究的基本方法,因而获得1925年的诺贝尔化学奖。用这种超显微镜能分辨的颗粒大小为
A. 10nm B. 200nm
C. 1000nm D. 10000nm
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
下列各组离子在水溶液里能大量共存,但用盐酸酸化后,不能大量共存的是
A. Na+、K+、Cl-、S2O32- B. Al3+、K+、CO32-、SO42-
C. Al3+、Cl-、NO3-、NH4+ D. Fe3+、K+、NO3-、SO42-
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
某学生设计了如下图中的方法对A盐进行鉴定:
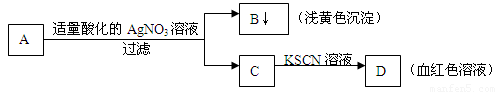
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
等质量的单质A和化合物B分别和足量水反应产生C、D两种气体单质。一定条件下,产生的C和D两种气体单质恰好可完全反应,则下列判断中正确的是
A. A和B的摩尔质量相同
B. 组成A、B的元素均为短周期元素
C. 等质量的A和B所含的质子数相同
D. 等物质的量的A和B与足量水反应产生的气体的体积比为(同温同压下)为2:1
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:填空题
完成下列各小题中的化学反应方程式。
⑴碱金属与O2反应生成氧化物较复杂,有普通氧化物(如Na2O)过氧化物(如Na2O2)还有超氧化物和臭氧化物等。因此要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。试用化学方程式表示以下反应:①钠与过氧化钠反应 。
②钾还原硝酸钾还产生了一种单质气体 。
⑵铝能从许多氧化物中夺取氧,利用铝的亲氧性除用于冶炼难熔金属外,还用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混和均匀,浮在金属表面上,然后在高温下煅烧,生成耐热的TiC,写出该反应的化学方程式 。
⑶将Al(OH)3和Na2CO3的混和物一同溶于氢氟酸可制得电解法炼铝必需的熔剂冰晶石(Na3AlF6),同时反应中产生一种无色无味的气体,试写出有关化学方程式_________________。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:填空题
过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与O-O键之间的空间夹角约为97°
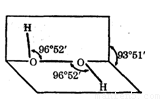
⑴H2O2的电子式为 ,其分子属于 (填:“极性”或“非极性”)分子。
⑵经测定,H2O2为二元弱酸,其酸性比碳酸弱,请写出其第一步的电离方程式_____________。
⑶H2O2溶液与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 ,
并在方程式上标出电子转移的方向与数目。
⑷为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。则下列物质能使过碳酸钠较快失效的是(多选) 。
A. MnO2 B. H2S C. 稀H2SO4 D. NaHCO3
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:填空题
在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式 ,反应中的还原剂是 ,每摩NaBH4反应时电子转移数为 mol。
⑵若将NaBH4投入酸溶液中其反应速率与其放入水中相比,应快还是慢 ,理由是 。
⑶NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:
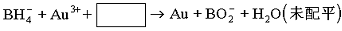
请写出配平的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com