
科目: 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
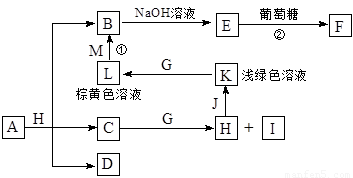
请回答下列问题:
(1)写出A的化学式______________,C的电子式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
_______________________________________________。
(4)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称____、______、_______。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 .
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;写出D与E形成分子的电子式 ;D所在族元素的氢化物中,沸点最低的是 .
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 .
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
(1)洗气瓶用途的延伸:利用如图所示的装置收集以下8种气体:
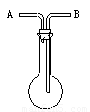
①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥CO2、⑦O2、⑧SO2、⑨C2H4
(A)若烧瓶是干燥的,把装置颠倒放置由B口进气,可收集的气体有_______
(B)若在烧瓶内充满水,可收集的气体有________,气体应由____口进入
(2)下列实验能达到实验目的且符合安全要求的是 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
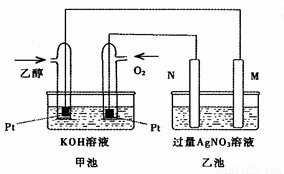
(1)M电极的材料是 ,电极名称是 ,N的电极反应式为 ,加入乙醇的铂电极的电极反应式 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为 。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
Fe(OH)2在空气中极易被氧化,而使实验室制取存在一定困难,人们尝试用多种方法来制得白色的Fe(OH)2沉淀。


(1)方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①配制FeSO4溶液时,在蒸馏水中加入硫酸亚铁晶体外还需加入 。
②除去蒸馏水中溶解的O2常采用 的方法。
(2)方法二:用电解法制Fe(OH)2,实验装置如上左图所示。
①电解时,电解质溶液应选用下列试剂中的 (填编号字母)
A.氯化钠溶液 B.稀硫酸 C.硫酸铜溶液 D.碳酸钠溶液
②电解时阴极的电极反应为: 。
③电解质溶液液面复盖一层苯所起的作用是 。
(3)方法三:在如上图右装置,先打开止水夹,反应一段时间后关闭止水夹,右侧试管内可见到白色沉淀。
①该法可使沉淀的白色维持较长时间,其原因是 。
②该法操作不当,在右侧试管中得不到沉淀,其原因是 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:填空题
某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用: 。
②用化学平衡原理解释通空气的目的: 。
(2)过程Ⅱ:在微生物作用下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:


①第一步反应是 反应(选填“放热”或“吸热”),判断依据是 。
②1 mol NH (aq)全部氧化成NO (aq)的热化学方程式是 。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三上学期11月月考化学卷 题型:计算题
钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
① 计算此钢样粉术中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到100mL相通浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:

计算硫酸溶液的物质的量浓度。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
人们常说,表面文章当少做。不过,德国科学家格哈德·特尔却因研究“表面文章”——表面化学成果辉煌而荣获2007年度“诺贝尔化学奖”。他不仅开创了表面化学的方法论,更造就了许多惠及人类日常生活的应用成果,其中埃特尔有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置,为减轻汽车尾气污染作出了重大贡献。下列有关说法:①汽车尾气中含有CO、碳氢化合物(CxHy)、NOx等有害气体,②汽车尾气是现代大城市的重要污染源之一,③汽车尾气可能导致光化学烟雾,④净化器中铂催化剂表面上可能发生的反应有:2xCO+2NOx=2xCO2
+N2。其中正确的是
A.①②③④ B.②③④ C.①②④ D.①②③
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
科学家将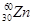 和
和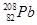 两原子经核聚合放出一定数目的中子,得到112号的新元素,该元素原子的质量数为267。下列有关该元素的说法正确的是
两原子经核聚合放出一定数目的中子,得到112号的新元素,该元素原子的质量数为267。下列有关该元素的说法正确的是
A.位于第七周期第ⅣA族
B.该原子中,中子数与质子数之差为43
C.原子核外共有6个电子层
D.具有“两性”
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.2L 1mol·L-1 (NH4)2SO4溶液中含有4NA个铵根离子
B.0.1mol铜与足量硫磺充分反应,转移的电子数为0.2 NA
C.某温度下,1L pH=6的纯水中,含1.0×10-6NA个OH-
D.一定条件下用含1mol FeCl3的溶液制备Fe(OH)3胶体,产生NA个Fe(OH)3胶粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com