
科目: 来源:2010-2011学年浙江省宁波市高三高考模拟试题(理综)化学部分 题型:填空题
(14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。 已知:
|
化学键 |
N≡N |
H—O |
N—H |
O=O |
|
键能/kJ·mol-1 |
945 |
463 |
391 |
498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
|
生成NH3量/(10-6mo1/L) |
4.8 |
5.9 |
6.0 |
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为 ▲ ;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条) ▲ 、 ▲ ;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:

① 往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
▲ 。
② 煅烧炉中产生的固态副产品为 ▲ ,生产流程中能被循环利用的物质X为 ▲ 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省宁波市高三高考模拟试题(理综)化学部分 题型:实验题
(15分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+ —— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
|
滴定次数 实验数据 |
1 |
2 |
3 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
|
V(KMnO4)/mL(初读数) |
0.00 |
0.20 |
0.00 |
|
V(KMnO4)/mL(终读数) |
15.85 |
15.22 |
14.98 |
[交流与讨论]
(1)准备的实验用品中,不需要的仪器有(填序号) ▲ ;不需要的试剂有(填序号) ▲ 。
(2)本实验所用的KMnO4标准溶液的物质的量浓度为 ▲ 。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是 ▲ (填字母序号)。
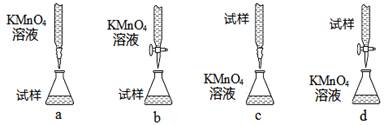
(4)判断滴定终点的依据是 ▲ 。
(5)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量会 ▲ (偏大、偏小、无影响)。
(6)根据实验数据,计算该补血剂中铁元素的含量 ▲ 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省宁波市高三高考模拟试题(理综)化学部分 题型:填空题
(14分)芳香族化合物A广泛存在于植物中,具有光敏性、抗菌和消炎作用。经实验测定,A由碳、氢、氧三种元素组成,相对分子质量小于200,其中碳、氢元素的质量分数之和为78.1%。经红外光谱测定,在A的结构中存在C=O双键和C−O单键,不含O−H。A经下列步骤转变为乙二酸和水杨酸。
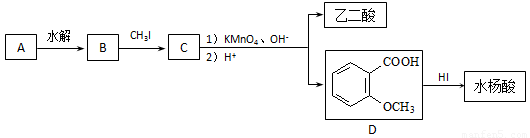
已知:(1)Mr(B)=Mr(A)+18,Mr(C)=Mr(B)+14;[Mr(X)表示物质X的相对分子质量]
(2)CH3CH2CH=CHCH3 CH3CH2COOH+CH3COOH
CH3CH2COOH+CH3COOH
请回答下列问题:
(1)请写出A的分子式 ▲ ;
(2)写出“A —→ B反应”的化学方程式: ▲ ;
“D —→ 水杨酸”的反应类型是 ▲ 。
(3)在上述转化过程中,设计反应步骤“B—→ C”的目的是 ▲ 。
(4)聚乙二酸丁二醇酯(PBSA)是目前正在实用化的生物降解性塑料之一,可以用于生产食品容器及包装材料。请写出乙二酸与1,4-丁二醇( CH2CH2
CH2CH2 )反应合成PBSA的化学方程式: ▲ 。
)反应合成PBSA的化学方程式: ▲ 。
(5)化合物D有多种同分异构体,其中一类同分异构体具有如下特点:
①苯的二取代物,且其苯环上的一氯代物有两种。
②能发生银镜反应,与氯化铁溶液发生显色反应。
请写出这类同分异构体的任意两种结构简式: ▲ 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
“混盐”是指一种金属离子与多种酸根离子构成的盐,如CaOCl2就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是( )
A . Ca(NO3)Cl B.(NH4)2Fe(SO4)2 C.Mg7(OH)6(CO3)4 D. K3[Fe(CN)6]
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
化学与生产、生活、社会密切相关。下列有关说法中不正确的是( )
A.2009年12月在哥本哈根召开的国际气候会议受到全球政要的广泛关注。减缓工业生产大量二氧化硫的排放以抑制全球气候变暖成为该会议的主题
B.针对目前甲型H1N1流感的扩散情况,要加强对环境、个人的消毒预防。其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质
C.2009年诺贝尔物理学奖授予华裔科学家高锟,是因其在光纤材料领域取得了卓越贡献。光纤的主要成分与玛瑙相同,通常情况下不与强氧化剂和强酸反应
D.建国60周年庆典晚会上,天安门广场燃放的焰火是某些金属元素魅力的展现
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C. MgO的熔点很高,可用于制作耐高温材料
D. 电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.2L 1mol·L-1 (NH4)2SO4溶液中含有4NA个铵根离子
B.0.1mol铜与足量硫磺充分反应,转移的电子数为0.2 NA
C.某温度下,1L pH=6的纯水中,含1.0×10-6NA个OH-
D.一定条件下用含1mol FeCl3的溶液制备Fe(OH)3胶体,产生NA个Fe(OH)3胶粒
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
下列离子方程式正确的是( )
A.NH4HCO3溶液中加入过量稀NaOH溶液:NH4++ OH-=NH3·H2O
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-[来源:ZXXK]
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水 Fe2++2H++H2O2=Fe3++2H2O
D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):
HSO3-+Br2+H2O=3H++2Br-+SO42-
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
下列判断正确的是( )
A.25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa等体积混合,溶液呈酸性:c(CH3COO-)+ c(OH-)<c(CH3COOH)+ c(H+)
B.相同条件下,2mol氯原子所具有的能量小于1mol氯分子所具有的能量
C.0.1 mol/L的碳酸钠溶液的pH大于0.1 mol/L的醋酸钠溶液的pH
D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(H+)==c(OH¯)
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2
 Cu, ②CuO
Cu, ②CuO
 CuSO4
CuSO4
 Cu。
Cu。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是( )
A.相等 B.①多 C.②多 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com