
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:选择题
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥根据分散剂的直径大小,分散系可分为溶液、胶体和浊液
A.②⑤ B.②③⑥ C.①②④ D.②③④⑤
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的组合是( )
① 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
②含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
③标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA。
④ 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
⑤ 100 mL 1 mol·L-1 AlCl3溶液中含阳离子数大于0.1NA
⑥ 50 mL 12 mol•L-1 浓盐酸与足量二氧化锰加热反应,转移电子数小于0.3 NA
⑦ 13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA
A.①②⑥ B.①⑤⑥⑦ C.②④⑥⑦ D.③⑤⑥
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:选择题
下列热化学方程式或说法正确的是
A.甲烷的燃烧热为△H=-890kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890 kJ∙mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g) 2NH3(g)
△H=-38.6kJ∙mol-1
2NH3(g)
△H=-38.6kJ∙mol-1
C.已知:H2(g)+F2(g) = 2HF(g);△H= —270 kJ/mol,
则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:选择题
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反映为黄色。下列判断正确的是
A.金属性:Y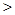 Z
B 氢化物的沸点:
Z
B 氢化物的沸点: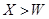
C.离子的还原性: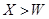 D 原子及离子半径:
D 原子及离子半径: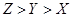
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:选择题
盖斯定律认为能量总是守恒的,化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)=H2O(1);△H1=-Q1 kJ•mol-1 ②C2H5OH(g)=C2H2OH(1);△H2=-Q2 kJ•mol-1
③C2H2OH(g)+3O2(g)=2CO2(g)+3H2O(g); △H3=-Q3 kJ•mol-1 ,若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为多少kJ
A.Q1+Q2+Q3 B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3 D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:选择题
如下图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池电的化学方程式为:

(II)为电解池的示意图。

当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是
A.电极A上发生的反应为:2S22---2e-=S42-
B.K+从右到左通过离子交换膜
C.电极X上发生的反应为:2Cl--2e-=Cl2↑
D.当有0.1 mol K+通过离子交换膜,Y电极上产生2.24 L气体(标准状况)
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:填空题
(15分)A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出,部分产物可能省略),其中反应①是置换反应。
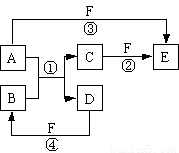
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要一定条件才能发生,A、D相遇有白烟生成,则C与F反应的化学方程式是 。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有颜色气体生成,反应④的化学方程式是 。
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:实验题
(13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。

请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(2分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。
查看答案和解析>>
科目: 来源:2010-2011学年河南省辉县市高三上学期第四次月考理综化学卷 题型:填空题
(14分)A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。
(1)D的原子结构示意图为__________________,丙的电子式为____________________,E在周期表中的位置为_____________。
(2)下列说法正确的有__________________________
① 化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为 C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④ 化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应____________。
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:
___________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com