
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:选择题
下列离子方程式错误的是
A.氯气通入水中:C12 + H2O  H+ + C1-+ HClO
H+ + C1-+ HClO
B.向3%的双氧水中通入少量SO2:H2O2 + SO2 === 2H+ + SO42-
C.碳酸钠水解:CO32- + 2H2O  H2CO3 + 2OH-
H2CO3 + 2OH-
D.向NaHCO3溶液中加入过量石灰水:Ca2+ + OH-+ HCO3-== CaCO3↓+ H2O
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:选择题
下列现象或反应的原理解释正确的是
|
选项 |
现象或反应 |
原理解释 |
|
A |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
|
B |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
|
C |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
|
D |
2CO = 2C + O2在任何条件下均不能自发进行 |
该反应△H > 0,△S < 0 |
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:选择题
某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33g。下列说法正确的是
A.该溶液中可能含有Na+ B.该溶液中肯定含有NH4+、S042-、CO32-、NO3-
C.该溶液中一定不含NO3- D.该溶液中一定含Na+,且c(Na+)≥0.1 mol/L
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:选择题
铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为
A.3.12 g B. 4.18 g C.4.68 g D.5.08 g
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:选择题
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-具有相同的电子层结构,下列叙述一定不正确的是
A.离子半径A2- > C- > B2+ B.它们的原子序数A > B > C
C.它们的原子半径C > B > A D.原子最外层上的电子数C > A > B
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:填空题
(14分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
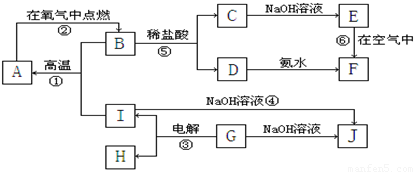
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第__ _周期、第_ __族 ;
(2)写出反应①的化学方程式___________ _________;
(3)写出D和J的水溶液反应的离子方程式_______ ___;
(4)写出反应③的电极方程式:阳极: ;
阴极: 。
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
(6)反应④中的氧化剂是_____________________。
(7)B的化学式:_______________,H的结构式: 。
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:填空题
(14分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
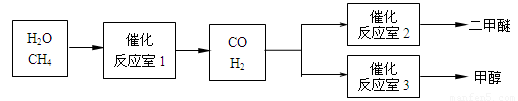 请填空:
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0。
CO(g)+3H2(g)
△H>0。
在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)= mol·L-1·min-1。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
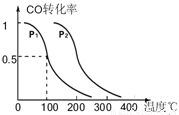
① P1 P2 (填“<”、“>”或“=”)。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”,下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为
(用含a、V的代数式表示)。
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:实验题
(15分)[实验探究]已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)仅限选用的仪器和试剂有:烧杯、试管、 玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。
完成以下实验探究过程:
[提出假设]
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
[设计实验方案]
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
验证假设1的方案:
本方案所用到的主要玻璃仪器有: 。
验证假设2的方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉-碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”),理由是 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:填空题
[化学——选修化学与技术](15分)
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填选项的标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2(g)+1/2O2(g)=SO3(g);△H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出) 千焦能量;
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
|
沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
|
矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
查看答案和解析>>
科目: 来源:2010-2011学年江西省联盟高三第一次联考理综化学部分 题型:填空题
[化学——选修物质结构与性质](15分)
乙炔是有机合成工业的一种原料。工业上曾用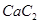 与水反应生成乙炔。
与水反应生成乙炔。
(1)将乙炔通入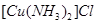 溶液生成
溶液生成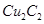 红棕色沉淀。
红棕色沉淀。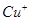 基态核外电子排布式为
。
基态核外电子排布式为
。
(2) Ca2+的原子结构示意图:
;已知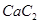 中
中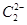 与
与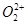 互为等电子体,
互为等电子体,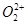 的电子式可表示为
;1mol
的电子式可表示为
;1mol 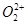 中含有的
中含有的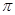 键数目为
。
键数目为
。
(3)乙炔与氢氰酸反应可得丙烯腈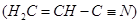 。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
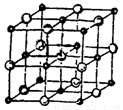
(4)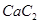 晶体的晶胞结构与
晶体的晶胞结构与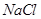 晶体的相似(如下图所示),但
晶体的相似(如下图所示),但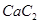 晶体中含有的哑铃形
晶体中含有的哑铃形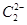 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。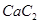 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的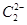 数目为
。
数目为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com