
科目: 来源:2010-2011学年江苏省高三第一次模拟考试化学试卷 题型:填空题
(12分)锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
(1)上述工艺回收到的产物有Al (OH)3、 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是 。
(3)酸浸时反应的化学方程式为 。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是 。
(4) 生成Li2CO3的化学反应方程式为 。已知Li2CO3在水中的溶解度随着温度的升高而减小,所以在浓缩结晶后要 过滤。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省高三第一次模拟考试化学试卷 题型:填空题
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= —889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C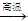 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H = Q kJ·mol-1
C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
查看答案和解析>>
科目: 来源:2010-2011学年江苏省高三第一次模拟考试化学试卷 题型:填空题
(10分)现有甲、乙、丙、丁四种物质,乙、丁的焰色反应均为黄色。丙是一种强酸的酸式盐,将丙加入BaCl2溶液有不溶于盐酸的白色沉淀生成,丁晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对甲、乙、丙、丁进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答:
(1)将D溶液蒸干得到的固体是: (写化学式)。
(2)C的结构式是 。
(3) 写出D溶液与过量的C反应的离子方程式 。
(4)电解戊的水溶液一段时间后,收集到的三种气体为无色气体B和两种单质气体,写出电解戊溶液的总方程式: 。
(5)有人设想在适当大小的管道中填充一定量的丁的晶体(摩尔质量在280∽300之间),管道环绕在一个房子的周围,这样的房子白天晚上室内温度可保持相对恒定,请简述其原理: 。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省高三第一次模拟考试化学试卷 题型:填空题
(12分)有机物A为羊肉的特征香成分。其合成路线如下:

(1)B的结构简式为 。
(2)下列关于D的说法中正确的是 (填序号)。
① 能发生消去反应 ② 能使溴的四氯化碳溶液褪色
③ 结构中存在一个手性碳原子 ④ 分子式为C7H14O
(3)B→C的化学反应方程式为 。
 (4)与C含有相同官能团,分子结构中含有一个
,,核磁共振氢谱有3个峰,且峰面积之比为9︰2︰1的同分异构体的结构简式为
。
(4)与C含有相同官能团,分子结构中含有一个
,,核磁共振氢谱有3个峰,且峰面积之比为9︰2︰1的同分异构体的结构简式为
。
(5)请设计合理方案,完成从 到
到 的合成路线(用流程图表示,并注明反应条件)。
的合成路线(用流程图表示,并注明反应条件)。
提示:①利用题目中给出的已知信息;
②合成过程中无机试剂任选:
③合成路线流程图示例如下:

查看答案和解析>>
科目: 来源:2010-2011学年江苏省高三第一次模拟考试化学试卷 题型:填空题
(10分)工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气 m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水 吨。
(2) 若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为 %(保留两位有效数字)。
(3) 若同时生产质量分数为50%的醋酸m1吨和质量分数为100%的冰醋酸m2吨,若不额外补充水,则m1+m2=__________吨。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省高三第一次模拟考试化学试卷 题型:填空题
Ⅰ.第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似。试回答:
(1)Ga的基态原子的价电子的轨道排布式为 。
(2)下列说法正确的是 (选填序号)。
A.砷和镓都属于p区元素 B.GaN、GaP、GaAs均为分子晶体
C.电负性:As>Ga D.第一电离能Ga>As
(3)GaAs是由(CH3)3Ga和AsH3在一定条件下制得,同时得到另一物质,该物质分子是 (填“极性分子”或“非极性分子”)。(CH3)3Ga中镓原子的杂化方式为 。
Ⅱ.氧化钙晶体的晶胞如图所示,试回答:
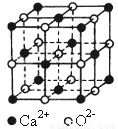
(1)晶体中Ca2+的配位数为 。
(2)已知Ca2+的半径为a cm,O2-的半径为b cm,NA代表阿伏加德罗常数,
该晶体的密度为 g/cm3。(用含a、b、NA的代数式表示)
查看答案和解析>>
科目: 来源:2010-2011学年江苏省高三第一次模拟考试化学试卷 题型:实验题
某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动
使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① ②
IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-
②
IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省苏北四市高三第二次调研考试化学试卷 题型:选择题
化学与以节能减排为基础的低碳经济密切相关。下列做法违背发展低碳经济的是
A.城市采用分质供水,收集雨水进行综合利用
B.大力发展汽车产业,鼓励市民购买家用汽车
C.推广煤的气化、液化技术,提供清洁高效燃料
D.开发利用太阳能、风能、氢能、核能等能源
查看答案和解析>>
科目: 来源:2010-2011学年江苏省苏北四市高三第二次调研考试化学试卷 题型:选择题
下列化学用语使用正确的是
A.HCN分子的结构式:H—C≡N
B.水分子的球棍模型:
C.F-离子的结构示意图: D.二氧化碳的电子式:
D.二氧化碳的电子式: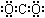
查看答案和解析>>
科目: 来源:2010-2011学年江苏省苏北四市高三第二次调研考试化学试卷 题型:选择题
下列离子方程式表达正确的是
A.SO2通入溴水中:SO2 + 2H2O + Br2 =2H+ + SO42- + 2HBr
B.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓ + 2H2O
C.漂白粉溶液在空气中失效:ClO- + CO2 + H2O = HClO + HCO3-
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com