
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:选择题
灰黄霉素是一种抗真菌药,可由甲和乙在三级丁醇体系中合成,反应式如下:

下列说法不正确的是
A.甲和乙的反应属于加成反应
B.乙的一种同分异构体是
C.乙物质分子中所有的碳原子不可能在同一平面上
D.1mol灰黄霉素最多能与4molH2发生加成反应
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:选择题
下列实验操作与预期的实验目的或结论均正确的是
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 |
验证两者都发生了水解反应,且相互促进 |
|
B |
苯酚溶液中加入几滴稀溴水没有白色沉淀出现 |
说明苯酚与溴没有发生反应 |
|
C |
常温下白磷可自燃而氮气需要在放电时才与氧气反应 |
非金属性:P>N |
|
D |
向相同体积、相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积 |
可以比较两种一元酸的酸性相对强弱 |
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:选择题
下图是甲醇/过氧化氢燃料电池内部结构示意图。工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能。下列说法正确的是
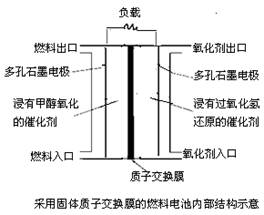
A.该电池的正极反应式:H2O2+2H++2e-=2H2O
B.燃料腔中的多孔石墨电极为该燃料电池的正极
C.电池工作时,1mol甲醇被还原有6mol电子转移
D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:选择题
下列溶液中有关物质的量浓度关系正确的是
A.25℃时pH=12的NaOH溶液与pH=12的氨水中: c(Na+)=c(NH4+)
B.Na2CO3和NaHCO3混合溶液中一定有:
2c(CO32-)+c(OH-)+ c(HCO3-)=c(H+)+c(Na+)
C.pH=4的0.1mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.将①pH=2的CH3COOH溶液、②pH=2的盐酸、③0.01mol/L的氨水、④0.01mol/L的NaOH溶液,分别稀释100倍后溶液中的c(H+):②>①>④>③
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:选择题
已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
A.升高温度,该反应的平衡常数将增大
B.再向该容器中充入1molH2和1molCO2,达到平衡时,H2的转化率将高于CO2
C.加入催化剂或从平衡混合气中分离出水蒸气均可提高CO2和H2的利用率
D.T℃,在容积可变的密闭容器中将3molH2和1molCO2混合,达到平衡时乙醇的体积分
数大于a
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:实验题
(12分)四氧化三铁纳米微粒可用于涂料、油墨、隐身材料、磁记录、电极材料、催化剂等多领域,实验室可用如下的方法来制备这种材料并进行检测。
Ⅰ.制备

(1)溶解、沉淀操作中不断通入氮气有两个作用:①是通过在反应过程中通入气体形成微型气泡,将刚生成的四氧化三铁微粒包围,来阻止微粒的长大或聚集成团;② ▲ 。
(2)操作Ⅲ的名称是________▲___ 。
Ⅱ.产品检测
一、定性检测:产品中铁元素价态检测
试剂主要有:3mol/L硫酸、0.1mol/L氢氧化钠溶液、20%硫氰化钾溶液、0.01mol/L酸性高锰酸钾溶液、氯水 (其它用品任选)
(3)请选用上述试剂完成下表
|
步骤 |
操作 |
现象、结论 |
|
1 |
▲ |
|
|
2 |
取少量产品于试管中加适量步骤1处理好溶液溶解,配成溶液 |
固体溶解,溶液呈浅黄色 |
|
3 |
取少量步骤2配好溶液于试管中,滴加几滴20%硫氰化钾溶液,振荡 |
▲ ,产品含有Fe3+ |
|
4 |
▲ |
▲ ,产品含有Fe2+ |
二、定量测定:
称取23.2g样品于烧杯中,加入加热煮沸后的稀硫酸充分溶解,并不断加热、搅拌,待固体完全溶解后,向所得溶液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。取滤液体积的1/10用浓度为0.200 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积29.80mL。
(4)产品中Fe3+和Fe2+的物质的量之比为 ▲ 。
III.结果讨论
(5)产品中Fe3+和Fe2+的物质的量之比略大于2:1的可能原因是 ▲ 。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(10分)烧结法制氧化铝生产过程如下:
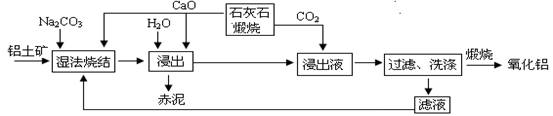
已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。 ②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式 ▲ 。
(2)浸出时再加入CaO的目的是 ▲ 。
(3)浸出液中发生的生成Al(OH)3的离子反应方程式 ▲ 。
(4)滤液的主要成分是 ▲ (写化学式);滤液循环使用的优点 ▲ 。(任答一点)
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
|
方法Ⅰ |
用炭粉在高温条件下还原CuO |
|
方法Ⅱ |
电解法,反应为2Cu + H2O |
|
方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 ▲ 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = ▲ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 ▲ 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ▲ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是 ▲ (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min—1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(12分)MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下:
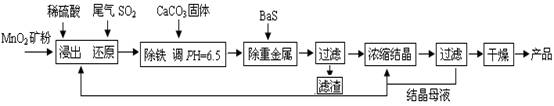
已知: 常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 ▲ 。
(2)除铁发生的离子反应方程式为 ▲ 。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= ▲ mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
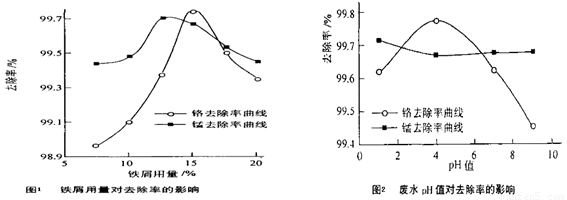
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 ▲ 时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= ▲ 时锰、铬去除率最好
查看答案和解析>>
科目: 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(14分)布洛芬、非诺洛芬、酮洛芬是一类芳基丙酸类非甾体抗炎药,具有抗炎作用强、毒副作用低的药效特点。
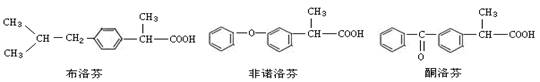
其中酮洛芬可由芳香族含氧衍生物A经以下路线合成得到:

请根据合成酮洛芬的路线回答下列问题。
(1)已知有机物A可以与NaHCO3反应,则A的结构简式为 ▲ 。
 (2)上述合成酮洛芬的路线中共有5步反应,其中属于取代反应的共有几步? ▲ 。其中有一步反应中用到有机物
,请写出实验室保存该有机物方法:
▲ 。
(2)上述合成酮洛芬的路线中共有5步反应,其中属于取代反应的共有几步? ▲ 。其中有一步反应中用到有机物
,请写出实验室保存该有机物方法:
▲ 。
(3) 布洛芬、非诺洛芬、酮洛芬都可视作2-苯基丙酸的衍生物,则芳香族含氧衍生物A与2-苯基丙酸的关系是 ▲ ;请写出满足下列条件的2-苯基丙酸的一种同分异构体的结构简式 ▲ 。
①苯的衍生物,且苯环上的一硝基取代物只有两种;②能与银氨溶液反应产生光亮的银境;
③能与FeCl3溶液发生显色反应。
(4)参照上述合成路线中的有关信息,写出由对二甲苯为主要原料制备
 的合成流程图(无机试剂任选)。
的合成流程图(无机试剂任选)。
合成线路图示例如下:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com