
科目: 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:填空题
环己烷()在负载纳米Au的分子筛(Au/TS1)催化剂的作用下与空气发生氧化反应,反应原理是:通过游离基反应形成环己基过氧化氢,该过氧化物在Au/TS1催化作用下受热分解,生成环己醇和环己酮(O)。由于环己醇、环己酮比环己烷更容易被氧化,因而有许多副产物(如己二酸及一些酯类化合物)生成。
(1) 下表是某反应温度下,环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)的结果:
|
催化剂 |
转化率(x)/% |
|
|
|
|
目标产物的选择性(S)/% |
|
|
|
|
|
环己基过氧化氢 |
环己醇 |
环己酮 |
|
|
|
Au/TS1 |
10.4 |
14.1 |
34.9 |
39.8 |
① 写出环己烷催化氧化为环己酮的化学方程式: 。
② 若在反应容器中加入1.0mol环己烷,则生成的环己酮的物质的量为________(保留2位小数)。
(2) 图甲是反应温度对环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)和目标产物的总收率(y)的影响。

① 由图甲可知:该反应较适宜的反应温度为________左右。
② 随着反应温度的升高,环己烷的转化率(x)逐渐增加,而目标产物的选择性(S)和目标产物的总收率(y)却逐渐降低,其可能的原因是 。
(3) 图乙是反应时间对环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)和目标产物的总收率(y)的影响。
① 由图乙可知,该反应较适宜的反应时间为________左右。
② 随着反应时间的延长,环己烷的转化率(x)逐渐增加,而目标产物的选择性(S)逐渐降低,这说明________________________________________________________。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:填空题
拉氧头孢钠是一种抗生素,合成拉氧头孢钠的中间体G的路线如下:
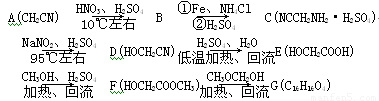
(1) B的结构简式为____________________。
(2) E―→F的反应类型为________________。
(3) 酚的苯环上某些氢原子比较活泼。由E合成F时还可能生成一种相对分子持量为194的副产物H,H的结构简式为______________________。
(4) M是E的同分异构体,M具有以下特征:① 苯环上只有2个取代基;② 遇氯化铁显色,但与小苏打不反应;③ 1mol M最多能与2mol NaOH溶液反应。则M的结构有________种。
(5) G含有酯基,请写出F―→G的化学反应方程式: 。
(6) 写出由化合物E制备化合物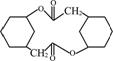 的合成路线流程图(无机试剂任选)。合成路线流程图示例:
的合成路线流程图(无机试剂任选)。合成路线流程图示例:
查看答案和解析>>
科目: 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:实验题
由黄铜矿为原料(主要成分为CuFeS2)制备99.95%~99.98%精铜的流程如下:
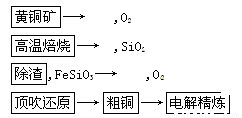
(1) 高温焙烧第一反应为2CuFeS2+4O2===Cu2S+2FeO+3SO2,该反应中氧化剂为____________。产物Cu2S在1 200℃高温下继续反应:2Cu2S+3O2===2Cu2O+2SO2,2Cu2O+Cu2S===6Cu+SO2。6mol CuFeS2和14.25mol O2反应,理论上可得到Cu________mol(假定各步反应都完全)。
(2) 取三份质量均为16.9g的上述粗铜,成分为Cu、Fe、Zn。现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
① 取一份粗铜放入足量稀硫酸中,共放出氢气1.568L。
② 另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
③ 再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28g。
求粗铜中Cu的质量分数(保留一位小数)。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:填空题
A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是 。

|
电离能/kJ·mol-1 |
I1 |
I2 |
|
铜 |
746 |
1958 |
|
锌 |
906 |
1733 |
(3) 下列说法正确的是________。
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为________________。
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是____________________________________________。在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为________________。
B. 制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离。下面是某化学兴趣小组的活动记录:
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.9 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
实验方案:
Ⅰ. 溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解。
Ⅱ. 蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩。在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图所示)中趁热过滤析出的晶体。得晶体m1g。

Ⅲ. 冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤。得KNO3粗产品m2g。
Ⅳ. 重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
假定:① 盐类共存时不影响各自的溶解度;② 各种过滤操作过程中,溶剂的损耗忽略不计。试回答有关问题:
(1) 操作Ⅱ中趁热过滤的目的是 。
(2) 若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=______g,其中混有NaCl______g。为防止NaCl混入,在操作Ⅱ中承接滤液的烧杯中至少应加入蒸馏水______g。
(3) 操作Ⅲ中采用减压过滤,其优点是______________________________________。该小组同学所用的装置如右图所示,试写出该装置中主要用到的玻璃仪器的名称:________________。若实验过程中发现倒吸现象,应采取的措施是______________________________________。
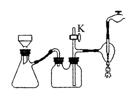
查看答案和解析>>
科目: 来源:2010-2011学年江苏省姜堰市高三上学期学情调查(三)化学试卷 题型:选择题
6月5日是世界环境日,今年世界环境日主题是 “转变传统观念,促进低碳经济”,号召各国减少温室气体的排放。下列行为中不符合“促进低碳经济”宗旨的是 ( )
A.提高能源效率、寻找替代能源、保护森林提倡生态友好型消费
B.推广以液化石油气代替天然气作民用燃料
C.推广利用二氧化碳与环氧丙烷和琥珀酸酐的三元共聚物的生物降解材料
D.推广“绿色自由”计划,吸收空气中CO2并利用廉价能源合成
查看答案和解析>>
科目: 来源:2010-2011学年江苏省姜堰市高三上学期学情调查(三)化学试卷 题型:选择题
下列表示物质结构的化学用语或模型图正确的是 ( )
A.H2O2的电子式: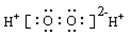
B.14C的原子结构示意图: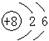
C.聚氯乙烯的结构简式: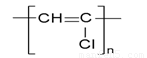
D.丙烷分子的球棍模型示意图: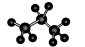
查看答案和解析>>
科目: 来源:2010-2011学年江苏省姜堰市高三上学期学情调查(三)化学试卷 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.1molFeCl3和沸水完全反应转化为氢氧化铁胶体后,其中胶体粒子数目为NA
B.标准状况下,1L液态水中含有的H+ 数目10-7NA
C.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
D.13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA
查看答案和解析>>
科目: 来源:2010-2011学年江苏省姜堰市高三上学期学情调查(三)化学试卷 题型:选择题
下列离子方程式中,正确的是 ( )
A.向次氯酸钙溶液中通入少量二氧化硫: Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
B.用Na2CO3溶液作洗涤剂:CO32- + 2H2O H2CO3 + 2OH-
C.用碳酸钠溶液吸收少量二氧化硫: 2CO32-+SO2+H2O ==2HCO3-+SO32-
D.酸性条件下KIO3溶液与KI溶液发生反应生成I2: IO3-+5I-+3H2O=3I2+6OH-
查看答案和解析>>
科目: 来源:2010-2011学年江苏省姜堰市高三上学期学情调查(三)化学试卷 题型:选择题
对下列事实的解释错误的是 ( )
A.用75%的乙醇溶液进行消毒,是由于乙醇能使蛋白质变性
B.医疗上用硫酸钡作“钡餐”,是由于硫酸钡难溶于水
C.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应
D.向Na2O2与水完全反应后的溶液中加MnO2,产生O2,是由于该溶液中含H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com