
科目: 来源:2010-2011学年广东省高三第二次综合测试(理综)化学试题 题型:填空题
下面是以化合物I为原料合成一种香精(化合物Ⅵ)的合成路线,反应在一定条件下进行。化合物Ⅵ广泛用于香精的调香剂。
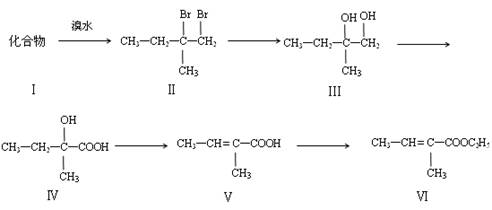
回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为 。
(2)化合物Ⅲ生成化合物Ⅳ发生 反应。
(3)化合物Ⅴ的多种同分异构体中,与化合物Ⅴ官能团种类相同且无支链的共有_____种。
(4)化合物Ⅵ不能发生的反应类型是 (填字母)。
A.加成反应 B.酯化反应 C.水解反应 D.加聚反应
(5)写出化合物Ⅵ在一定条件下反应,生成高分子化合物的化学方程式: 。
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第二次综合测试(理综)化学试题 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)
 CH3OH(g)
ΔH1
CH3OH(g)
ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
ΔH2
CH3OH(g) + H2O(g)
ΔH2
①反应Ⅱ的平衡常数表达式是 。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为 。
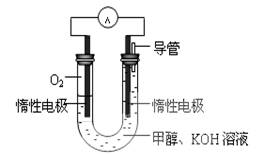
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第二次综合测试(理综)化学试题 题型:填空题
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
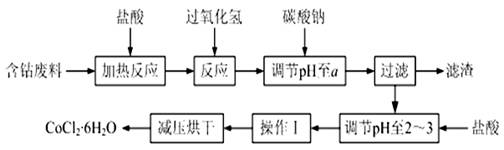
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴加入过氧化氢的作用是(用离子方程式表示) 。
⑵加入碳酸钠调节pH至a得到的滤渣可部分溶于氢氧化钠溶液, a的范围是 。
⑶操作Ⅰ包含3个基本实验操作,它们是 。
⑷制得的CoCl2·6H2O需减压烘干的原因是 。
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第二次综合测试(理综)化学试题 题型:实验题
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白(可能用到的相对原子质量:Al-27)
[探究一] 实验方案: 。
。
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(“偏高”或“偏低”)
[探究二] 实验方案: (实验装置如下图)
(实验装置如下图)

问题讨论:
为使测定结果尽可能精确,实验中应注意的问题是(写出可能的一点):
。
[探究三] 实验方案:称量m g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:欲计算Mg的质量分数,该实验中还需测定的数据是 。
[实验拓展] 请你另设计一个实验方案,测定该铝镁合金中镁的质量分数(书写形式可以模仿探究一、二实验方案) 。
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第五次综合测试(理综)化学试题 题型:选择题
短周期非金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
A.原子半径:甲<乙
|
甲 |
乙 |
|
|
丙 |
丁 |
戊 |
B.非金属性:乙<丁
C.最高价氧化物的水化物的酸性:丙<丁
D.最外层电子数:丙>丁>戊
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第五次综合测试(理综)化学试题 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)
A.1.8g的NH4+离子中含有nA个电子
B.标准状况下,22.4L水中含有nA个H2O分子
C.常温常压下,33.6 L Cl2中含有1.5nA个C12分子
D.1 mol·L-1 Na2SO4溶液中有2nA个Na+
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第五次综合测试(理综)化学试题 题型:选择题
下列关于钢铁腐蚀与防护的说法正确的是
A.钢铁与电源的正极连接,钢铁可被保护
B.钢铁发生析氢腐蚀时,负极反应为:Fe-3e-=Fe3+
C.与铜质水龙头连接的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中能发生电化学腐蚀
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第五次综合测试(理综)化学试题 题型:选择题
下列实验设计或实验操作中,正确的是
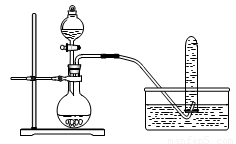
A.铜与浓硝酸反应制NO2:可采用下图装置
B.分离乙酸和乙醇溶液:用分液漏斗进行分离
C.稀硫酸和锌粒反应制取氢气:加入少许硫酸铜以加快反应速率
D.鉴别Na2CO3溶液和NaHCO3溶液:分别向两种溶液滴加澄清石灰水至过量
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第五次综合测试(理综)化学试题 题型:选择题
下列说法正确的是
A.高锰酸钾可以氧化苯与甲烷
B.苯、乙醇和乙酸都可以发生取代反应
C.乙烷、乙醇和乙酸都可以与钠反应生成氢气
D.纤维素和蛋白质水解产物均是葡萄糖
查看答案和解析>>
科目: 来源:2010-2011学年广东省高三第五次综合测试(理综)化学试题 题型:选择题
汽车尾气净化中的一个反应如下: 2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-746.8kJ·mol-1
N2(g)+2CO2(g)△H=-746.8kJ·mol-1 ,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是
,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是
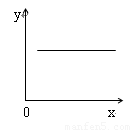
A.当X表示温度时,Y表示平衡常数K
B.当X表示温度时,Y表示CO的转化率
C.当X表示N2的物质的量时,Y表示NO的转化率
D.当X表示NO的物质的量时,Y表示平衡常数K
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com