
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:选择题
下列说法中,不正确的是
A.明矾净水过程中利用了胶体的吸附作用
B.不法分子制作假鸡蛋用的海藻酸钠、氯化钙以及碳酸钙都属于盐
C.碳纤维、黏胶纤维、醋酸纤维都属于有机高分子材料
D.广州亚运会火炬“潮流”采用丙烷(C3H6)作燃料,充分燃烧后只生成CO2和H2O
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:选择题
下列关于常见有机化合物的说法中,正确的是
A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应
B.分子式为C5H12的有机物只有三种,它们互为同分异构体,性质完全相同
C.甲烷、苯、乙醇、乙酸和乙酸乙酯都能发生氧化反应和取代反应
D.糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:选择题
下列判断中,正确的是
A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂
B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物
C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡
D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:选择题
若用NA表示阿伏加德罗常数,下列说法中,正确的是
A.12.5gCH2==CHCl和12.5g [ CH2—CHCl ]n中含氯原子数均为0.2NA
B.18g2H2O和18g3H2O中含有的质子数均为10NA
C.23gNa与氧气完全反应,消耗氧气分子数一定为0.5NA
D.84g NaHCO3固定和106g Na2CO3固体中CO2-3的数目均为NA
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:选择题
下列说法中,不正确的是
A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种
B.第三周期元素的离子半径大小比较:Cl->S2+>Na+>Mg2+>Al3+
C.日本福岛核电站释放出的放射性核素131I与132I、133I互为同位素
D.相同条件下,通过测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:选择题
水的电离平衡曲线如图所示。下列说法中,正确的是
A.图中A、D、E三点处KW间的关系:E处>A处>D处
B.温度不变时,往水中通入适量HCl气体,可以使水的电离[来源:ZXXK]
从A点变化到D点
C.温度不变时,在水中加入适量CH3COONa固体,可以使水
的电离从A点变化到C点
D.在B点处,0.5mol·L-1的H2SO4溶液与1mol·L-1的KOH溶液等体积混合,充分反应后,所得溶液的pH=7
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:实验题
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2

①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:填空题
(13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1
①下列措施中,不能提高碳的转化率的是 (填字母序号)。
a.容器的容积不变,增加水蒸汽的物质的量
b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知,C(s)+CO2(g) 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。
CO2(g)+H2(g)的焓变(△H)为 。
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
 ①a处通入的是
(填物质名称),左侧电极上发
①a处通入的是
(填物质名称),左侧电极上发
生 (填“氧化”或“还原”)反应。
②该电池工作过程中,H+的移动方向为从 到
(填“左”或“右”)
③该电池正极反应式为 。
④若用该电池提供的电能电解60mL NaCl溶液,设有
0.01molCH3OH完全放电,NaCl足量,且电解产生的
Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH= 。
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应,
CO(g)+H2O(g) CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:

①在实验1中,以v(CO2)表示该反应的反应速率为 mol·L-1·min-1;
②在实验2中,t 5。(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:填空题
(14分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)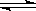 Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
SrSO3(s)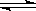 Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 。(用沉淀溶解再平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将 ;
②增大CO2-3的浓度,平衡常数K将 。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用试剂为 ;实验现象及其相应结论 。
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。
你认为该推理是否严密?试说明理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com