
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:选择题
在容积不变的密闭容器中有反应:X(g) + Y(g)  z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是
z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是

A. A点与B点相比,B点的c (X)大
B. A点与C点的化学反应速率:前者<后者
C.在反应进行到D点时,V正〉V逆
D.该反应的正反应是吸热反应
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:选择题
已知某温度下,Ka (HCN)= 6.2×10-10 mol·L-1、Ka (HF)= 6.8×10 - 4 mol·L-1、Ka (CH3COOH)= 1.8×10-5 mol·L-1、Ka (HNO2)= 6.4×10 - 6 mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.HCN溶液 B.HF溶液 C.CH3COOH溶液 D.HNO2溶液
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:选择题
下列所述的氢氰酸(HCN)性质中,可以证明它是弱电解质的是
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1NaOH溶液完全反应
D.在相同温度、相同浓度条件下,HCN溶液的导电性比硫酸溶液的弱
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:选择题
下图为一原电池的结构示意图,下列说法中,不正确的是

A. 原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:选择题
相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积为下列的
A.仍相同 B.醋酸溶液的大 C.盐酸的大 D.无法判断
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:填空题
(8分)25OC时,0.1 mol · L-1 HCl溶液中,[Cl-] =__________,[ OH-] =___________,Kw=______________;
若向15mL此溶液中加入15mL 0.3 mol · L-1 NaOH溶液,则混合液pH=________。
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:填空题
(8分)(1))25OC时,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) c(CH3COO-)(填“ >” 或“=”或“<”,)。
(2)25OC时, pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 (填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) c(CH3COO-)(填“ >” 或“=”或“<”,)。
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:填空题
(8分)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:填空题
(10分)已知反应:CO
(g) + H2O(g) CO2 (g) + H2(g)
CO2 (g) + H2(g)
(1)将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某温度下达到平衡:此时有2/3的CO转化为CO2。则该反应平衡常数的表达式为___ ___,此温度下平衡常数为 。
(2)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2,则达到平衡时与(1)相比较,
平衡应 移动(填“向正反应方向”、“向逆反应方向”或“不”),此时平衡混合气中CO2的体积分数约是下列各值中的 (填编号)
A. 22.2% B.27.55% C.33.3% D.36.8%
(3)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2和1mol H2O(g),则达到平衡时与(1)相比较,则下列说法中正确的是 (填序号)
①生成物的产量一定增加 ②反应物的浓度一定降低
③反应物的转化率一定增加 ④CO在平衡混合气中的百分含量一定降低
查看答案和解析>>
科目: 来源:2010-2011学年山东省济南市高三12月质量调研检测化学试卷B卷 题型:填空题
(15分)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) ; △Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ; △H b =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为 kJ ,生成的CO2气体标准状况下体积是 L
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在 极反应;电极反应式为 。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
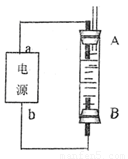
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化是 ,反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com