
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:选择题
下列说法中正确的是
A.所有的烷烃都是同系物
B.在适合的条件下,含有双键的分子都能发生加成反应
C.用Br2的CCl4溶液或KMnO4(H+)都可以区别烯烃和芳香烃
D.丙烯与氯气在光照条件下反应,最多可以得到三种沸点不同的有机物
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.4.2g聚乙烯中含有的碳原子数目为0.3NA
B.25℃时,pH=1的H2SO4溶液中含有的H+数目为0.1NA
C.7.8gNa2O2与足量的水反应,转移的电子总数为0.2NA
D.在有浓硫酸并加热的条件下,1mol乙酸和1mol乙醇充分反应最后生成NA个乙酸乙酯分子
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:选择题
已知甲酸(HCOOH)是比乙酸酸性略强的一元弱酸。关于浓度均为0.1mol/L的三种溶液:①HCOOH ②NaOH ③HCOONa,下列说法中不正确的是
A. c(HCOO-):③>① B.水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(OH-)=c(H+)+c(HCOOH)
D. ①和③等体积混合后的溶液:c(HCOO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:选择题
下列关于右图所示装置的说法中,正确的是

A.若M是电流计,则该装置可以将电能转化为化学能
B.若M是直流电源,一段时间后铜棒上可以镀上铂
C.若M是直流电源,当有1.12L(标准状况)气体生成时,电路中转移了0.2mole-
D.M无论是电流计还是直流电源,该装置中都有反应Ag+ + e- = Ag 发生
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:选择题
在100mL,1mol/L的HCl和CH3COOH两种溶液中,分别加入足量的锌粒,下列各图中正确的是
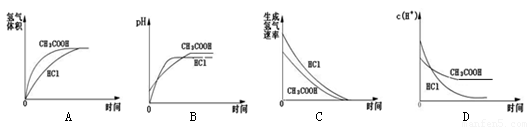
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:填空题
A、B、C、D、E、F六种物质,一定条件下有如下图所示的转化关系(所有的反应物和生成物均已给出):
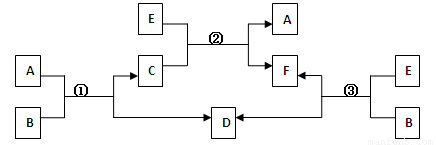
(1)若①、②、③均为水溶液中的置换反应,且A、D、E是常见的卤素单质,B、C、F为化合物。则A、D、E的氧化性由强到弱的顺序为 (用字母表示),其中A的化学式为 (用元素符号表示)。
(2)若B是一种淡黄色固体,绿色植物的呼吸作用和光合作用可实现自然界中D和E的循环,则F的化学式为 ;反应①的离子方程式是 。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是 ;反应③是某些氮肥厂获得合成氨原料D的一个重要反应,假设反应后的气体中只有F和D,从综合经济效益的角度考虑,简述如何从反应后的混合物中分离出D。 。
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:填空题
室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三: ;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10 KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设 是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,② ,③干燥。
步骤三:利用下图所示装置,进行定量分析:
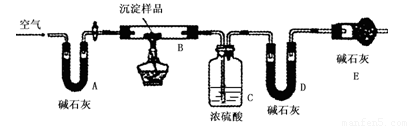
① A装置中玻璃仪器的名称是 。
② 仪器组装好后首先要进行的实验操作是 。
③ 实验结束时通入过量的空气的作用是 。
④ 数据记录:
|
|
B装置的质量(g) |
C装置的质量(g) |
D装置的质量(g) |
|
实验前 |
15.4 |
262.1 |
223.8 |
|
试验后 |
6.1 |
264.8 |
230.4 |
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为 。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式 。
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:填空题
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH >0
Fe(s)+CO2(g) ΔH >0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应向_______进行(填“左”或“右”),判断依据是
。
(2)一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)。
已知:2CO(g) + O2(g)=2CO2(g) ΔH =–566 kJ·mol―1
2H2O(g) =2H2(g) + O2(g) ΔH =+484 kJ·mol―1
CH3OH(g) + 1/2O2(g)=CO2(g) + 2H2(g) ΔH =–192.9 kJ·mol―1
请写出CO与H2在一定条件下反应生成CH3OH(g)的热化学方程式
。
(3)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
ΔH =-49.0
kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g)
ΔH =-49.0
kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ _;
②反应达到平衡后,下列措施能使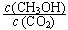 增大的是______(填符号)。
增大的是______(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g)
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:填空题
I.目前,我国采用“接触法”制硫酸,设备如图所示:
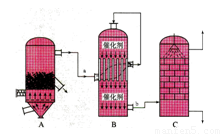
(1)图中设备A的名称是_____________ 该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
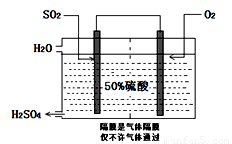
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为 。
II. 纯碱是一种重要的化工原料。目前制碱工业主要有 “氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式: ;
(2)写出“联合制碱法”有关反应的化学方程式: ;
。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,
“氨碱法”中CO2来源于 ;
查看答案和解析>>
科目: 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:填空题
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面。A、B两种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是 (填字母)。
a.M易溶于水,是因为M与水分子间能形成氢键,且M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔沸点都比二氧化硅晶体的低
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中E原子数为:__ __,E原子的配位数为:__ __。

(3)E的一种氧化物化学式为EO2,广泛用于制造高级白色油漆,也是许多反应的催化剂。工业上用含E的矿石[主要成分为FeEO3(不溶于水) ]作原料制取EO2。矿石经过硫酸溶液浸泡,生成含EO2+的溶液,再经稀释得EO2·xH2O,写出这两步反应的离子方程式 , 。
(4)X和Y分别是B和C的氢化物,这两种氢化物都含有18电子。X和Y的化学式分别是 、 。两者沸点的关系为X Y(>,或<),原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com