
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:选择题
某K2CO3样品中含有Na2CO3、KNO3 和Ba(OH)2三种杂质中的一种或两种。现将13.8克样品加入入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9克沉淀。对样品所含杂质的正确判断是( )
A. 一定含有KNO3 B. 一定含有KNO3,可能含有Na2CO3
C. 一定不含Ba(OH)2,可能含有KNO3 D. 一定不含Na2CO3和Ba(OH)2
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:选择题
H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3 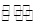 H+
+ HSO3- HSO3-
H+
+ HSO3- HSO3- 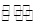 H+
+ SO32- H2CO3
H+
+ SO32- H2CO3 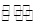 H+
+ HCO3-;HCO3-
H+
+ HCO3-;HCO3-
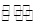 H+
+ CO32-;已知K1 > K1'
≈ K2 > K2',则溶液中不可以大量共存的离子组合是( )
H+
+ CO32-;已知K1 > K1'
≈ K2 > K2',则溶液中不可以大量共存的离子组合是( )
A. SO32-、HCO3- B. HSO3-、CO32- C. SO32-、CO32- D. HSO3-、HCO3-
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:填空题
某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将NF3、HF之外的反应物与生成物分别填入以下空格内。
NF3 + _______ → HF + ______ + __________
(2)反应过程中,被氧化与被还原的元素的物质的量之比为___________;
(3)配平该反应的化学方程式,并标出电子转移的方向和数目;
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄露,还是易于发现。,你判断该气体泄漏时的现象是_____________________;一旦NF3泄漏,可以用溶液__________(填化学式)喷淋的方法减少污染。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:填空题
A、B、M、X、Y、Z是短周期元素,且原子序数依次增大,已知它们的部分化合物的性质如下:
|
A的氢化物 |
B的氢化物 |
M的氢化物 |
X的氧化物 |
Y的氢化物分子构型 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
正四面体 |
对应水化物为最强酸 |
(1)M原子核外电子占据的轨道有________个,B的氢化物的电子式__________。
(2)M、X、Z三种元素简单离子的半径由大到小的顺序____________________(用离子符号和“>”表示)
(3)B的氢化物和Z的氢化物相遇时现象是____________________________。
(4)推测A和Y组成的化合物的熔点____________(填“高”或“低”),理由是________。
(5)A元素的氢化物有多种,1mol A的某种氢化物中含有14 mol电子,已知常温常压下1g该氢化物在足量氧气中充分燃烧生成液态水时放出热量为50 kJ,写出该反应的热化学方程式________________________________________。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:填空题
一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO (g) + 2H2 (g)  CH3OH
(g)
CH3OH
(g)
根据题意完成下列各题:

(1)反应达到平衡时,平衡常数表达式K=_________________ 升高温度,K值___________ (填“增大”、“减小”或“不变”)
(2)在500℃,从反应开始到平衡,H2的平均反应速率v (H2) = ___________
(3)在其它条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列说法正确的是__________
a. H2的浓度减少 b. 正反应速率加快,逆反应速率也加快
c .甲醇的物质的量增加 d. 重新平衡时n (H2) / n (CH3OH)增大
(4)据研究,反应过程中起催化作用的是Cu2O,反应体系中含有少量CO2有利于维持催化剂Cu2O的量不变,原因是________________(用化学方程式表示)
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:填空题
在盛有淀粉KI溶液的试管中,滴加少量的NaClO溶液和稀H2SO4,会立即看到溶液变为蓝色,这是因为______________________________,相应的离子方程式为__________在盛有淀粉和碘水的混合液中,滴加Na2SO3溶液,发现__________________现象,这是因为________________________,其离子方程式为______________________________,对于上述两组实验的结果,可得出:ClO-、I2、SO42-的氧化性强弱顺序为___________________。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:填空题
元素A---D是元素周期表中短周期的四种元素,据表中信息回答:
|
A |
单质是热和电的良导体,熔点97.81℃,沸点882.9℃,在O2中燃烧得到淡黄色固体 |
|
B |
原子核外有7种运动状态不同的电子 |
|
C |
单质在常温常压下是气体,原子的L层有一个未成对的P电子 |
|
D |
+2价阳离子的核外电子排布与氖原子相同 |
(1)B元素原子的最外层轨道表示式是____________________,D离子的核外电子排布式是__________________,C和D形成的化合物的电子式为_______________。
(2)A、B、C、D的原子半径由大到小顺序______________________(用元素符号表示)
(3)D单质在B单质中燃烧的化学方程式______________________________。
(4)A和D两元素金属性较强的是_________(用元素符号表示)。写出能证明该结论的一个实验事实______________________________________。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:实验题
某学习小组从海带中提取I2,实验步骤如下:
(1)实验室焙烧海带,需要下列仪器中的____________
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三角架 f.酒精灯
(2)将所得海带灰加水溶解、过滤,所需玻璃仪器有_______________________________
(3)在滤液中检出了I-,还检出了K+,检验K+的操作步骤是_______________________。
(4)经查阅资料,得知氧化性由强到弱的顺序为:Cl2 > IO3- > H2O2 > I2,他们决定用H2O2做氧化剂氧化KI,而不用Cl2,原因可能是____________________________。
(5)小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈_______色;打开分液漏斗活塞,却未见液体流下,原因可能是___________。
(6)根据以下数据推测:
①已知SiCl4的沸点是57.6℃,则CCl4的沸点_________(填“高”或“低”)于57.6℃
②已知I2的沸点是113.6℃,熔点是185.2℃,从碘的CCl4溶液中分离出碘单质,应采取的方法是___________。
A.过滤 B.升华 C.蒸发 D.蒸馏
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:填空题
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是_______________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5 (g)  4NO2
(g) + O2 (g) + Q (Q < 0 )
4NO2
(g) + O2 (g) + Q (Q < 0 )
①反应达到平衡后,若再通入一定量N2,则N2O5的转化率将________(填“增大”、“减小”或“不变”)
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
C(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_____________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2______T1(填“>”、“<”或“=”)
(3)如图所示装置可用于制备N2O5,
则N2O5在电解池的_______区生成,
其电极反应式为_______________________。
查看答案和解析>>
科目: 来源:2010-2011学年上海市高三上学期第一次月考化学试卷 题型:填空题
将一定量的SO2和含0.7mol的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2
(g) + O2(g) 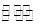 2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
(1)判断该反应达到平衡状态的标志是______________。
A.SO2和SO3浓度相等
B.SO2的百分含量保持不变
C.SO3的生成速率与SO2的消耗速率相等
D.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是_____________。
A. 向装置内再充入N2 B. 向装置内再充入O2
C. 改变反应的催化剂 D. 升高温度
(3)求该反应达到平衡时SO2的转化率
(4)若将平衡混合气体的5 %通入过量的BaCl2溶液,生成沉淀多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com