
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:选择题
一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3
mol·L-1、0.08
mol·L-1,则下列判断不合理的是(
)
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3
mol·L-1、0.08
mol·L-1,则下列判断不合理的是(
)
A.c1∶c2=1∶3 B.平衡时,Y和Z的生成速率之比为3∶2
C.X、Y的转化率不相等 D.c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:选择题
可逆反应mA(g)+nB(g)  pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:
pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:
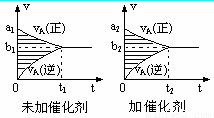
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是( )
A. ②④⑤⑦ B. ①④⑥⑧ C. ②③⑤⑧ D. ①③⑥⑦
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:填空题
(4分)有下列物质:①铜; ②硫酸钡固体; ③氢氧化钠固体; ④氨水;⑤熔融硝酸钾;⑥乙醇;⑦液态HCl;⑧石墨;⑨二氧化硫;⑩冰醋酸; ⑾硫。
(1)其中能导电的有________,其水溶液能导电的是________。
(2)属于非电解质的有________,属于强电解质的是________。
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:填空题
(4分)下列方法中可以证明3H2+N2  2NH3已达平衡状态的是___
_____
2NH3已达平衡状态的是___
_____
①单位时间内生成n mol H2的同时生成n mol NH3
②一个H—H键断裂的同时有两个H—N键断裂
③百分组成 N2%=NH3% ④反应速率ν(H2)正=3ν(N2)逆时
⑤c(NH3) ∶ c(H2) ∶ c(N2)=2 ∶ 3∶ 1时
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨条件一定,混合气体的总质量不再变化
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:填空题
(5分)在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变为红色。(1)再向溶液中滴入1mol/LFeC13溶液,现象 ,平衡 移动,KSCN浓度会 。
(2)在烧杯中加入KC1固体,现象 ,平衡 移动。(填“向逆反应方向”、“向正反应方向”或“不”)
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:填空题
(6分)在一容积为3 L的密闭容器内加入0.3 mol的N2和0.9 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
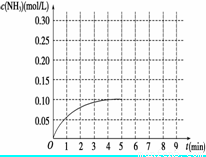
(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度 不可能为( )
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡 移动 (填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数 _(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:填空题
(6分)在一个固定容积的密闭容器中,保持一定温度进行以下反应:H2(g)+Br2(g)  2HBr(g),已知加入0.5 mol H2和1 mol Br2时,达到平衡后生成0.5a mol HBr(见表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g),已知加入0.5 mol H2和1 mol Br2时,达到平衡后生成0.5a mol HBr(见表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号(1)~(3)的状态,填写表中的空白。
|
编号 |
起始状态/ mol |
平衡时HBr的物质的量 / mol |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
0.5 |
1 |
0 |
0.5a |
|
(1) |
2 |
4 |
0 |
① |
|
(2) |
② |
③ |
1 |
0.5a |
|
(3) |
m |
n(n≥2m) |
④ |
⑤ |
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:填空题
(7分)(1)室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于
(2)室温时,将0.1 mol/L盐酸和0.07mol/L氢氧化钡溶液1:5(体积比)混合后,该混合溶液的pH=_______
(3)某温度时,0.1 mol·L-1 NaOH溶液的pH=12。该温度下,10体积pH=a的某强酸与1体积pH=b的某强碱混合后,溶液呈中性,则a和b满足的关系____________________
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高二上学期第一次考试化学试卷 题型:实验题
(8分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当,也消耗1 mol OH-],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。(1)根据步骤Ⅲ填空:
①用NaOH标准溶液滴定滴定锥形瓶中溶液时,左手控制 式滴定管,右手摇动锥形瓶,眼睛注视______________ _。直到因加入一滴NaOH溶液后,溶液由无色变为红色,并且______________ 为止
②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
③移取25.00 mL样品的滴定管,移取前尖嘴处有气泡,移取后气泡消失,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
第一次 |
25.00 |
1.02 |
20.99 |
|
第二次 |
25.00 |
2.00 |
22.03 |
|
第三次 |
25.00 |
0.00 |
22.00 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
查看答案和解析>>
科目: 来源:2011-2012年辽宁省高一10月月考化学试卷 题型:选择题
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在55~36 nm的磁流体。下列说法中正确的是 ( )
A.所得的分散系属于悬浊液 B.该分散系能产生丁达尔效应
C.所得的分散系中分散质为Fe2O3 D.给分散系通直流电时,阳极周围黑色加深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com