
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:选择题
在一定温度下,下列叙述不是可逆反应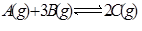 达到平衡的标志的是( )
达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)2v正(B)=3v逆(C);(5)混合气体的总压强不再变化;(6)混合气体的物质的量不再变化;(7)混合气体的平均相对分子质量保持不变时;(8)A、B、C的分子数目比为1:3:2。
A. (2)(8) B. (7)(4) C. (1)(3) D. (5)(6)
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:选择题
已知热化学方程式: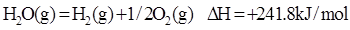
H2(g)+1/2O2(g)=H2O(l) △H=-285.8KJ/mol 当lg液态水变为水蒸汽时,其热量变化是
A.吸热88kJ B.吸热2.44J C.放热44kJ D.吸热44kJ
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:选择题
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:选择题
在2升的密闭容器中,发生以下反应:2A(气)+B(气)  2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:选择题
在可逆反应中,改变下列条件一定能加快反应速率的是
A.增大反应物的量 B.升高温度 C.增大压强 D.使用催化剂
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:选择题
已知(1)H2O(g) == H2O(l) ΔH1=—Q1 kJ·mol-1(2)CH3OH(g) == CH3OH(l) △H2=—Q2 kJ·mol-1 (3)2CH3OH(g) +3O2(g) == 2CO2(g)+4H2O(g) △H3=—Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ) ( )
A. Q1+Q2+Q3 B. 0.5 Q3-Q2+2Q1 C. 0.5 Q3+ Q2-2Q1 D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:填空题
(6分)写出298K时,下列反应的热化学方程式
(1)28 g CO还原Fe2O3生成单质铁,放出8.3 kJ热量;
(2)N2和O2化合生成184 g NO2气体,吸收热量135.4 kJ;
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:填空题
(3分)工业制氢气的一个重要反应是:CO(s)+ H2O(g) == CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) == CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) == CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g) == H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(s)+ H2O(g) == CO2(g) + H2(g)的反应热_______ kJ·mol-1
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:填空题
(3分) 已知下列反应的焓变
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
(2)C(s)+O2(g) ==CO2(g) △H2=-393.5kJ/mol
(3) 2 H2(g)+O2(g) ==2H2O(l) △H3= -285.8kJ/mol
试计算反应 2C(s)+2H2(g)+O2(g) ==CH3COOH(l)的焓变ΔH=
查看答案和解析>>
科目: 来源:2011-2012年河南省长葛市高二上学期第一次月考化学试卷 题型:填空题
(12分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com