
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:选择题
下列四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是( )
A.过量①与②分别与少量的锌(大小相同)反应时,开始时刻速率相同,反应中速率:①<②
B.将②、③两种溶液混合后,若呈中性,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.将③稀释a倍,将④稀释b倍,两溶液pH相等,则a<b倍
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g)
△H=-92.6 kJ/moL。实验测得起始、平衡时有关数据如下表:
2NH3(g)
△H=-92.6 kJ/moL。实验测得起始、平衡时有关数据如下表:
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
N2 |
H2 |
NH3 |
||
① |
1 |
3 |
0 |
放出热量:23.15kJ |
② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应达平衡时,状态完全相同
B.①平衡时,N2的转化率为25%
C.容器②中达平衡时放出的热量Q<23.15 kJ
D.若向容器①加入2molN2、6molH2,则平衡时放出的热量23.15kJ <Q1<46.3 kJ
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:选择题
有关离子浓度大小比较的判断正确的是( )
A.常温下NaB溶液的pH=8,c(Na+)- c(B-)=1×10-2 mol/L
B.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.KHSO3溶液呈酸性,c(K+)>c(HSO3-)>c(H+)> c(SO32-)>c(OH-)
D.0.1mol·L-1 NH4Cl和0.1mol·L-1 NH3·H2O等体积混合后溶液呈碱性:
c(NH3·H2O) >c(Cl-) > c(NH4+)> c(OH-) >c(H+)
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:填空题
(13分) 现有常温时浓度相同的五种电解质溶液:
①CH3COOH ②Na2CO ③HNO3 ④CH
③HNO3 ④CH COONa ⑤NaOH
COONa ⑤NaOH
(1)五种溶质中是弱电解质的是______(填编号),若常温时该弱电解质电离常数为K,1mol/L的该溶液中c(H+)约为__________mol/L(用K表示)
(2)④溶液中离子与分子共______种(包括水分子)。
(3)这五种溶液的pH由小到大的顺序是______________________________(填编号)。
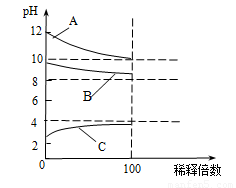
(4)将 CH COONa溶液稀释100倍时,其pH变化如图中_______曲线(填字母).
COONa溶液稀释100倍时,其pH变化如图中_______曲线(填字母).
(5)上述五种溶液中分别加入AlCl3溶液,有气泡产生的是 (填编号),写出能产生气泡现象的离子方程式: .
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:填空题
(8分) 常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略体积的变化),测得混合溶液的pH=9。试回答以下问题:
(1)液的pH=9的原因是_________________________(用离子方程式表示);
(2)混合后的溶液中由水电离出的c(OH-)为a,pH=9 的NaOH溶液中由水电离出的c(OH-)为b,则a b(填“>”、“<”或“=”),a︰b= 。
(3)在混合溶液中c(HA) + c(A-) = mol/L。
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:填空题
(12分) (1) 腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2,
①根据该反应设计一个原电池,在方框中画出该原电池装置图,注明电极材料和电解质溶液

②负极反应式 ;
正极反应式 。
(2) 利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
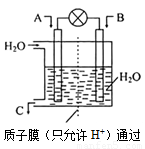
①若A为CO,B为H2, C为CH3OH,则通入CO的一极为_____极(填“正”或“负”)。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:______________________________________________。
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:填空题
(10分)向一个固定体积的密闭容器充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g) 3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
(1)用A表示2分钟内平均反应速率 ,A在第1分钟平均速率 第2分钟平均速率(填“<”、“>”、“=”)。
(2)器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(3)大B的转化率,可采取的措施是_________(用序号填空)
①加入A ②加入B ③加压 ④再加入1.6 mol A+ 0.8 mol B ⑤将C分离出容器
(4)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A + 2 mol B ②3mol C + 1 mol D + l mol B
③3 mol C + 2 mol D ④1.6 mol A+ 0.8 mol B + 0.6 mol C + 0.2 mol D
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:填空题
(17分) 重庆有丰富的天然气资源。以天然气为原料合成氨的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
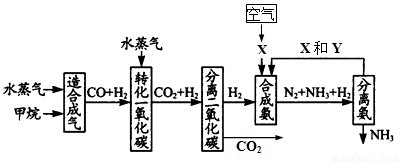
请填写下列空白:
(1)已知2mol甲烷与水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是_______________________________。
(2)图中X为_____,Y为_____(填化学式);常用K2CO3溶液吸收分离出的CO2,其离子方程式为_____________________________________
(3)在合成氨工业中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来。请运用化学平衡的观点说明采取该措施的理由:_______________________________。
(4)联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水最终可制得纯碱,如图所示
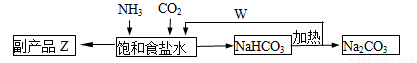
①应先向食盐水通足量_______气体(写化学式,后同);副产品Z为______,可用作______;W为_______。
②若生产 Na2CO3 5.3吨,理论上至少可制得副产品Z_______吨。
查看答案和解析>>
科目: 来源:2013届重庆市高二上学期期末考试化学试卷 题型:实验题
(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。
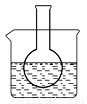
A.溶液显浅红色是因为Na2SO3水解呈酸性 B.水解反应为放热反应
C.水解反应为吸热反应 D.升高温度,Na2SO3水解程度增大
第二组:该小组讨论Fe3+和SO32-之间发生怎样的反应,提出了三种假设:①是发生氧化还原反应:2Fe3++SO32-+ H2O = 2Fe2++ SO42-+ 2H+;②是发生双水解反应:2Fe3++ 3SO32-+ 6H2O = 2Fe(OH)3(胶体) + 3H2SO3;③是两种反应同时发生。为了验证假设,同学们进行了下列实验,请填写下列空白:
(1) 用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2) 取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3) 由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。
查看答案和解析>>
科目: 来源:2014届重庆市高一上学期期中考试化学试卷 题型:选择题
下列实验操作会引起安全事故的是
A. 制氧气时用排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
B. 用氢气还原氧化铜时,先加热再通入氢气
C. 给试管中的液体加热时不停地移动试管或加入碎瓷片
D. 混合浓硫酸和乙醇时,将浓硫酸慢慢加入乙醇中并及时搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com