
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:选择题
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是 ( )
A.甲溶液含有Ba2+ B.乙溶液含有SO42- C.丙溶液含有Cl- D.丁溶液含有Mg2+
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:选择题
为配置NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
① 适量HCl ② 适量NaCl ③ 适量氨水 ④ 适量NaOH
A. ①② B. ③ C. ③④ D. ④
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:选择题
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是发生水解的物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是 ( )
A.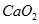 的水解产物是
的水解产物是 和
和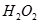
B.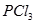 的水解产物是HClO和
的水解产物是HClO和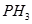
C.NaClO的水解产物之一是HClO
D.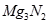 的水解产物是两种碱性物质
的水解产物是两种碱性物质
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:选择题
100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示。下列说法正确的( )
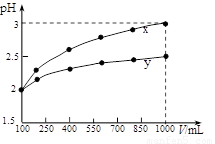
A.x为弱酸,y为强酸
B.稀释前x、y的物质的量浓度相等
C.随着稀释的进行,y的电离程度减小
D.等体积的x、y分别分别与足量的锌反应,y放出的氢气多
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:选择题
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3× 10-36mol2·L-2。 下列说法正确的是 ( )
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现
的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:选择题
下列说法不正确的是( )
A. 0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
B. 将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
C. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-)
D. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:填空题
(16分)(Ⅰ)某元素的原子序数为33,写出该元素原子的核外电子排布式 ,此元素的原子中被电子占据的轨道有 个,有 个能级(能量不同的轨道);
(Ⅱ)有五种元素A、B、C、D、E,A2+的电子层结构为1S22S22P63S23P63d5,B原子的M层为最外层且有两个未成对电子,C原子的L电子层的P轨道上有一个空轨道,D原子的L电子层的P轨道上只有一对成对电子,E原子的M电子层的P轨道半充满。写出A---E各元素的符号:A 、B 、C 、D 、E
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:填空题
(Ⅰ)(9分)
现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)现有下列电解质溶液:①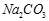 ②
②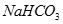 ?③
?③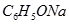 ? ④
? ④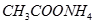 ⑤
⑤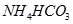 (已知酸性
(已知酸性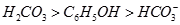 。)
。)
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号) 。
(2)常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号) > > 。
(3)写出⑤与足量NaOH溶液混合加热时反应的离子方程式 。
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:填空题
(7分)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为 ;
(2)估算该反应的平衡常数 (写计算结果)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向 移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。
查看答案和解析>>
科目: 来源:2013届福建省四地六校高二下学期第一次联考化学试卷 题型:填空题
(11分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
③废水III中的汞元素存在如下转化:
Hg2++ CH4 =CH3Hg++H+,我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+ 3×10-7mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr207溶液的仪器是 。(酸式滴定管或碱式滴定管)
②Ⅱ中,碎瓷片的作用是 。
③III中,发生的反应为:Cr2O2-7+6Fe2++14 H+=2Cr3++6Fe3++7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com