
科目: 来源:2013届福建省三明市高二上学期联合命题考试化学试卷 题型:选择题
一定条件下,在体积为2L的密闭容器中充入1 mol X和1 mol Y,发生下列反应:
2X(g)+Y(g) Z(g),反应经60 s达平衡,生成0.3 mol
Z 。下列说法正确的是
Z(g),反应经60 s达平衡,生成0.3 mol
Z 。下列说法正确的是
A.以X浓度变化表示的反应速率为0.005 mol·L-1·s-1
B.将容器体积变为4L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的DH>0
查看答案和解析>>
科目: 来源:2013届福建省三明市高二上学期联合命题考试化学试卷 题型:选择题
通过实验方法测得H2+Cl2 = 2HCl的化学反应速率v和反应物浓度c的关系式为:
v = k ·c(H2)m ·c(Cl2)n。式中k为常数,m、n的数值可用下表中数据确定。
|
c(H2) / mol·L-1 |
1.0 |
2.0 |
2.0 |
|
c(Cl2) / mol·L-1 |
1.0 |
1.0 |
4.0 |
|
v / mol·L-1·s-1 |
1.0 k |
2.0 k |
4.0 k |
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=1/2,n=1/2 C.m=1/2,n=1 D.m=1,n= 1/2
查看答案和解析>>
科目: 来源:2013届福建省三明市高二上学期联合命题考试化学试卷 题型:填空题
(14分)Ⅰ.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式: ;
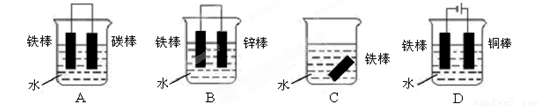
下列哪个装置示意图可防止铁棒被腐蚀 。
Ⅱ.某小组为研究电化学原理,设计如下图装置。请回答下列问题:
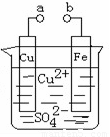
(1)a和b不连接时,铁片上发生反应的离子方程式为 ,此时能量转化形式主要是化学能转化为 能。
(2)a和b用导线连接时,外电路中的电子是从 电极流出(填“Fe”或“Cu”), (填Cu2+ 或SO42-)离子朝负极移动,Cu极所发生反应的电极反应式为 。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的 (填“正极”或“负极”)连接;此时铜片上发生的电极反应式为 。
查看答案和解析>>
科目: 来源:2013届福建省三明市高二上学期联合命题考试化学试卷 题型:填空题
(14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
|
实 验 混合溶液 |
A |
B |
C |
D |
E |
F |
|
4 mol·L-1H2SO4 / mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
|
饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
|
H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:V2 V5 = , V6= ,V8= ;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
|
组别 |
c(HA)/mo1·L-1 |
c(NaOH)/mo1·L-1 |
混合液pH |
|
甲 |
c |
0.2 |
pH = 7 |
|
乙 |
0.2 |
0.1 |
pH>7 |
|
丙 |
0.1 |
0.1 |
pH = 9 |
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ? (选填“是”或“否”)。
(5)分析乙组实验数据,HA是 酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是 。
(6)丙组所得混合液中由水电离出的c(OH-) = mo1·L-1。
查看答案和解析>>
科目: 来源:2013届福建省三明市高二上学期联合命题考试化学试卷 题型:填空题
(16分)Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH
(g) ΔH=
-90.8 kJ·mol-1
CH3OH
(g) ΔH=
-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=
-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=
-23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH=
-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=
-41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K
= 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K
= 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源:2013届福建省三明市高二上学期联合命题考试化学试卷 题型:实验题
(12分)实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO = 4H+ +(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤① 用电子天平准确称取样品1.5000 g。
步骤② 将样品溶解并冷却后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤③ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点。重复步骤③操作2次。
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变为 色,半分钟内不退色。
⑤滴定后俯视读数,测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.04 |
|
2 |
25.00 |
2.00 |
22.00 |
|
3 |
25.00 |
0.20 |
20.21 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为 。(保留两位小数)
查看答案和解析>>
科目: 来源:2014届福建省五校高一上学期期末联考化学试卷 题型:选择题
科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入研究。下列4组物质:①Mg、O2、N2、NO;②NaOH、Na2CO3、CH4、KCl;③H2CO3、H2SO4、NH3·H2O、H2SiO3;④CaO、SO2、CO2、SiO2.从物质的基本分类看,每组中都有一种物质与其他物质不属于同一类,这4种物质分别是( )
A、Mg、Na2CO3、H2CO3、CaO B、O2、NaOH、H2SO4、SiO2
C、NO 、CH4、NH3·H2O、 CaO D、NO、KCl、H2SiO3、 SO2
查看答案和解析>>
科目: 来源:2014届福建省五校高一上学期期末联考化学试卷 题型:选择题
下列类型的反应,一定没有发生电子转移的是( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
查看答案和解析>>
科目: 来源:2014届福建省五校高一上学期期末联考化学试卷 题型:选择题
下列情况会对人体健康造成较大危害的是( )
A 自来水中通入少量Cl2进行消毒杀菌
B 用SO2漂白食品
C 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D 用小苏打(NaHCO3)发酵面团制作馒头
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com