
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:选择题
在一定温度下,一定体积的的密闭容器中有如下平衡:H2(g)+I2(g)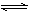 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达到平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1,达到平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A.0.16 B.0.08 C.0.04 D.0.02
查看答案和解析>>
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:填空题
(6分)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O 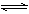 NH3·H2O
NH3·H2O 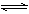 NH
NH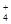 +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。
查看答案和解析>>
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:填空题
(5分)用标准酸液滴定待测碱液时,下列操作对所测碱液的物质的量浓度有何影响。
A、偏低 B、偏高 C、无影响
请用序号填空
(1)用待测液润洗锥形瓶后再注入所量取的一定体积待测液____________
(2)未用标准液润洗酸式滴定管就直接注入标准酸液________________ _
(3)用滴定管尖端未排气泡的碱式滴定管量取待测碱液_________________
(4)滴定前仰视读数、滴定后俯视读数_______________________________
(5)锥形瓶未润洗,且瓶中有少量蒸馏水_____________________________
查看答案和解析>>
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:填空题
(12分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
查看答案和解析>>
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:填空题
(4分)已知难溶于水的盐在水中存在溶解平衡: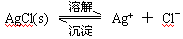
在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP = c(Ag+)·c(Cl-)=1.8·10-10 。
若把足量AgCl分别放入① 100 mL蒸馏水,② 100 mL 0.1 mol / L NaCl溶液,③ 100 mL 0.1 mol / L AlCl3溶液,④ 100 mL 0.1 mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______>______>______>______。在0.1 mol / L AlCl3溶液中,Ag+的物质的量浓度最多为_________mol / L。
查看答案和解析>>
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:填空题
(10分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
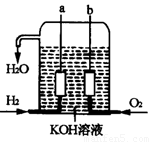
(1)a极是 极,b极是 极,
电极反应式分别为 , 。
(2)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式: 。此时电池内总的反应方程式为 。
查看答案和解析>>
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:填空题
(12分)在25 ℃时,用石墨电极电解2.0 L,2.5 mol/LCuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1) 极发生氧化反应(填阴,阳),电极反应式为 。
(2) 极发生还原反应(填阴,阳),电极反应式为 。
(3)有 mol电子发生转移,得到氧气的体积(标准状况)是 L ,溶液的pH是 。反应速率v(Cu2+):v(O2)==
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 g ,电解液的pH (填“变小”、“变大”或“不变”)
查看答案和解析>>
科目: 来源:2013届甘肃省白银市恒学校高二上学期期末考试化学(理)试卷 题型:填空题
(11分)已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。

(2)①前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。
②反应2NO2(g)  N2O4(g)在b点的平衡常数K(b)=
。
N2O4(g)在b点的平衡常数K(b)=
。
③反应2NO2(g)  N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d) K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是 (填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是
查看答案和解析>>
科目: 来源:2013届福建南平政和一中高二期末考试化学试卷 题型:选择题
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是 ( )
A.空气、硫酸铜、硫酸 B.盐酸、空气、纯碱
C.氧化铁、胆矾、熟石灰 D.硝酸、食盐水、烧碱
查看答案和解析>>
科目: 来源:2013届福建南平政和一中高二期末考试化学试卷 题型:选择题
下列关于原电池的叙述正确的是( )
A.原电池是将化学能转变成电能的装置 B.在原电池中失去电子的一极是阴极
C.原电池的两极一定是由活动性不同的两种金属组成 D.原电池的负极发生的是还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com