
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:选择题
某地酸雨中,c(Na+)=7.0×10-6 mol·L-1,c(Cl-)=3.5×10-5 mol ·L-1,
c(NH)=2.3×10-5mol/L,c(SO)=2.5×10-6 mol/L,则该地酸雨的pH为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:选择题
下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol/L的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:选择题
下列关于电解质溶液中离子关系的说法正确的是
A.0.1 mol·L-1NaHCO3溶液中离子浓度关系:
c(Na+)=2c(CO)+c(HCO)+c(H2CO3)
B.0.1 mol/L NH4Cl和0.1 mol·L-1 NH3·H2O等体积混合后离子浓度关系:
c(Cl-)>c(NH)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:
c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO、ClO-、Na+能大量共存
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:选择题
V下列各组离子在指定条件下,一定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO、NO
B.c(H+)=1×10-1 mol/L的溶液中:Cu2+、Al3+、SO、NO
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH、S2-、Br-
D.水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:填空题
(8分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)=H2O(g) △H=+44kJ·mol-1,则16 g液态肼和足量H2O2反应,生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)=2 NO2(g) △H=+67.7 kJ·mol-1, N2H4(g)+O2(g)= N2(g)+2H2O (g) △H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______________________ ____。
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:填空题
(8分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
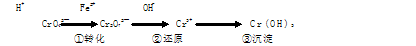
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同
b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:填空题
(8分) 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO  2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO) /mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO) / mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应是________ 反应(填写“吸热”、“放热”)。
(2)前2s内的平均反应速度v(N2)=________。
(3)此反应的平衡常数表达式为K=________。
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:填空题
(10分)在如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16g。试回答:
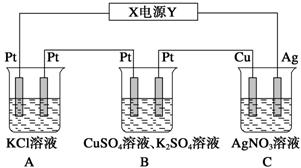
(1)电源中Y电极为直流电源的__________极。
(2)pH变化:A:________B:________ (填“增大”、“减小”或“不变”)。
(3) 若A中KCl溶液的体积是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
(4)B中电解CuSO4溶液的电极总反应:
查看答案和解析>>
科目: 来源:2013届甘肃兰州一中高二上学期期末考试化学试卷 题型:填空题
(10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:0.8< X <___________。
②写出K的基态原子的电子排布式:
K:_______________________________________
③根据表中的所给数据分析,同主族内的不同元素X的值变化的规律
是 ; 简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com