
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:选择题
在恒温恒容的密闭容器里发生可逆反应: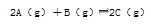 。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
A.2molA和1molB B.1molA和1molB
C.1molA和2molB D.1molB和1molC
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:选择题
下列说法或表示方法中正确的是
A.由C(石墨,s)→C(金刚石,s);ΔH= +2.1KJ/mol 可知,石墨比金刚石稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
C.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH= +285.8KJ/mol
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH= —57.3KJ/mol ,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3KJ/mol
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:选择题
在一定条件下,下列反应达到平衡时,反应物的转化率均为a%,
① PCl5(g) PCl3(g)+Cl2(g) ② 2HI(g)
PCl3(g)+Cl2(g) ② 2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
③ 2NO2(g) N2O4(g)
N2O4(g)
若保持各自的温度、体积不变,分别加入一定量的各自的反应物,则转化率
A.均不变 B.均增大 C.①增大②不变③减小 D.①减小②不变③增大
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:选择题
已知:①2CO(g)+ O2(g)== 2CO2(g) ΔH1= -566.0kJ/mol
②C(s)+O2(g)==CO2(g) ΔH2= -393.5kJ/mol
则1molC(s)在氧气中燃烧生成CO时的ΔH值为:
A.+172.5 kJ/mol B.-172.5 kJ/mol C.+110.5kJ/mol D.-110.5kJ/mol
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:选择题
在100℃时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A.平衡时,体系内含NO2为0.04mol·L-1 B.平衡时,N2O4的转化率为60%
C.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
D.在2s时,体系内压强为反应前的1.1倍
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:选择题
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,消耗金属锌 B.电池工作时,MnO2被还原为Mn2O3
C.电池正极的电极反应式为2MnO2+H2O+2e-==Mn2O3+2OH-
D.电解质KOH溶液浓度的大小对电池反应没有影响
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:选择题
下列说法正确的是
A.电极方程式:Cu-2e- = Cu2+,既能发生在原电池中,又能发生在电解池中
B.某温度下,10mL 0.1mol/L的H2SO4溶液与10mL 0.4 mol/L的KOH溶液混合后,pH=13
C.断裂1mol H-H、N-H、N≡N键需吸收的能量分别为a kJ、b kJ、c kJ,
则2NH3( g) 3H2(g)+N2(g) △H=(3a+c-6b) kJ/mol
3H2(g)+N2(g) △H=(3a+c-6b) kJ/mol
D.中和等体积的醋酸溶液,消耗等pH值的氨水和氢氧化钠溶液的体积分别为V1、V2,则V1<V2
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:填空题
如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)
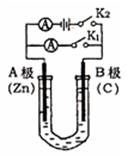
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目: 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:填空题
在容积为VL的密闭容器中发生2NO2 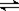 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
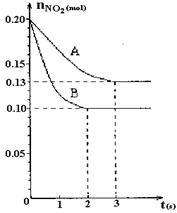
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是 。
A.有、无催化剂 B.温度不同 C.压强不同 D.V值不同
(2)写出该反应的化学平衡常数K的表达式: ,
并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是 。
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2  2NO2
2NO2

若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com