
科目: 来源:2013届河南省偃师市高二第二次月考化学试卷 题型:选择题
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B.SO42- C. Ba2+ D.NH4+
查看答案和解析>>
科目: 来源:2013届河南省偃师市高二第二次月考化学试卷 题型:选择题
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、SO42-、HCO3-、Cl-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A. 甲溶液含有Ba2+ B. 乙溶液含有SO42- C丙溶液含有Cl- D.丁溶液哈有Mg2+
查看答案和解析>>
科目: 来源:2013届河南省偃师市高二第二次月考化学试卷 题型:填空题
(8分)氯碱工业中电解饱和食盐水的原理示意图如图所示:
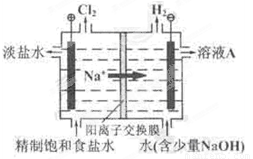
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)检验阳极反应产物的方法是:______________________________________________________
___________________________________________________________________________________
查看答案和解析>>
科目: 来源:2013届河南省偃师市高二第二次月考化学试卷 题型:填空题
(18分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:

(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _
(2)若两池中均为饱和NaCl溶液:
①乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”),写出乙池中该电极反应的离子方程式_______________________________________。
②甲池中碳极上电极反应式是_____________,检验该负极反应产物的方法是_____________________________用离子方程式表示_______________________________
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
查看答案和解析>>
科目: 来源:2013届河南省偃师市高二第二次月考化学试卷 题型:填空题
(10分)已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)=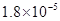 ,Ka(HSCN)=0.1,
,Ka(HSCN)=0.1,
难溶电解质的溶度积常数:Kap(CaF2)=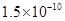
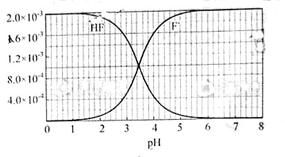
②25℃时,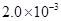 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据以下信息回答下旬问题: 图2
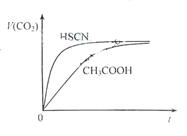
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka ,列式并说明得出该常数的理由
。
,列式并说明得出该常数的理由
。
(3)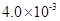 mol·L-1HF溶液与
mol·L-1HF溶液与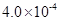 mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
(是,否)有沉淀产生
列式计算(过程):
查看答案和解析>>
科目: 来源:2013届河南省偃师市高二第二次月考化学试卷 题型:填空题
(14分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为

其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目: 来源:2014届河南省高一下学期第一次月考化学试卷 题型:选择题
我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的 ,每百吨
,每百吨 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以 的形式存在。下列说法正确的是(
)。
的形式存在。下列说法正确的是(
)。
A. 原子核内含有4个质子 B.
原子核内含有4个质子 B. 和
和 互为同位素
互为同位素
C. 原子核内含有3个中子
原子核内含有3个中子
D. 的最外层电子数为2,所以
的最外层电子数为2,所以 具有较强的金属性
具有较强的金属性
查看答案和解析>>
科目: 来源:2014届河南省高一下学期第一次月考化学试卷 题型:选择题
下列变化过程中,只破坏共价键的是 ( )
A.I2升华 B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸 D.从NH4HCO3中闻到了刺激性气味
查看答案和解析>>
科目: 来源:2014届河南省高一下学期第一次月考化学试卷 题型:选择题
X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为( )。
A.HX B.H2X C.XH4 D. XH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com