
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:选择题
已知一定温度下合成氨反应:N2 +3 H2 2 NH3 (每生成2 mol
NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
2 NH3 (每生成2 mol
NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.Q1 < 0.5 Q2 C.Q1 < Q2 < 184.8 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:选择题
可逆反应:3 A(g) 3 B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
3 B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C可能都是气体
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:选择题
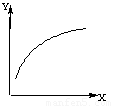
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) 2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
|
|
X |
Y |
|
A |
再加入A |
B的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
减小压强 |
A的转化率 |
|
D |
升高温度 |
混合气体平均摩尔质量 |
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:选择题
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
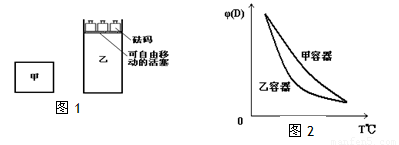
关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中反应均达平衡后,平衡体系中各组分的体积百分组成相同,浓度也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中c(C)是乙中c(C)的2倍
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:实验题
(12分)请用下图的装置设计一个实验,以测定SO2转化为SO3的转化率。
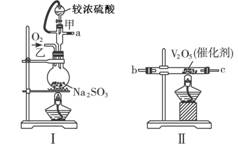

(1)这些装置的连接顺序(按气体从左到右的方向)是___________。(填各接口的编号)
(2)实验时甲仪器的作用与原理是____________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是________________________________。
(4)Ⅳ处观察到的现象是___________________________。
(5)在Ⅰ处用大火加热烧瓶时SO2的转化率会__________。(填“填大”“不变”或“减小”)
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为______________。
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:填空题
(18分)
Ⅰ.某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
(2)恒定温度、压强
①若x = 0,y = 0,则z _________;
②x、y、z应满足的一般条件是_______________________________。
Ⅱ.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2  2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_____和_____,或____和_____。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为: n(O2)平=a mol, n(CO2)平=b mol。
试求n(H2O)平=__________。(用含a、b的代数式表示)
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:填空题
(12分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 反应热不变 c. v正(H2) =v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c 2 |
c 3 |
c 3 |
|
4 |
c 1 |
c 2 |
c 3 |
c 3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:3 min时CO的浓度 c 1 = mol/L,H2O (g)的转化率= 。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是 表中5min~6min之间数值发生变化, 可能的原因是
a . 增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气浓度
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:填空题
(14分)
Ⅰ.在一定条件下的下列可逆反应达到平衡时,试填出:x
A+y B z C
z C
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是________;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向_____方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是______(填状态);
(4)如加热后,C的百分含量减小,则正反应是________热反应。
Ⅱ.如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)= a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g) 2Z(g)+W(g);ΔH<0。达到平衡时,V(A)= 1.2a L。
2Z(g)+W(g);ΔH<0。达到平衡时,V(A)= 1.2a L。

试回答:
(1)A中X的转化率α(A)___________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
查看答案和解析>>
科目: 来源:2013届江苏省高二12月练习化学试卷 题型:填空题
(12分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g) N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K)。
N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K)。
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________。
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”)。
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变),在_______时间段CO的转化率最大。
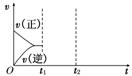
t1:增大NO的浓度 t2:降低温度
(4)通过计算判断该条件下反应能否自发进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com