
科目: 来源:2010年福建省高二上学期期中考试化学卷 题型:填空题
(16分)下图是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)== ZnSO4(aq) + Cu(s)。七彩教育网若该电池中两电极的总质量为300g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为298g。


请回答以下问题:
⑴R的名称是___________,其作用是__________________。R中的阳离子移向___________ (填A或B)中的溶液。
⑵电极Y的材料是________,B中的电解质溶液是________________。
⑶X为原电池的___ 极,其电极反应式是______________。
(4)产生铜的质量为 ;转移的电子的物质的量为 。
(5) 高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Fe电极作 极 (填“阴”或“阳”);
② Ni电极的电极反应式为: 。
查看答案和解析>>
科目: 来源:2010年福建省高二上学期期中考试化学卷 题型:填空题
(6分)
773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a
mol CO、2a
mol H2,平衡时能生成0.1a
mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a
mol CO、2a
mol H2,平衡时能生成0.1a
mol CH3OH,反应就具工业应用价值。

① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ 下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g) CH3OH(g);ΔH>-91
kJ·mol-1
CH3OH(g);ΔH>-91
kJ·mol-1
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
查看答案和解析>>
科目: 来源:2010年福建省高二上学期期中考试化学卷 题型:实验题
(27分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H=
—92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H=
—92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:

(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为: ,
第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),
第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数
K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)
+ 3H2O(1)  2NH3(g)
+
2NH3(g)
+  O2(g)
;△H = a kJ·mol—1
O2(g)
;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g)
+ 3H2(g) 2NH3(g)
ΔH= -92 .4kJ·mol—1
2NH3(g)
ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
查看答案和解析>>
科目: 来源:2010年福建省高二上学期期中考试化学卷 题型:实验题
在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol,D为6.5 mol,F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。请填写以下空白:

(1)若x=4.5,则右侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于__________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?__________(填“相等”“不相等”或“不能确定”)。其理由是_______________________。
查看答案和解析>>
科目: 来源:2010年福建省高三上学期第二次月考试卷化学试题 题型:选择题
我国三峡工程所提供的清洁、价廉、可再生的水电,相当于每年燃烧500万吨原煤的火力发电厂生产的电能,因此三峡工程有助于控制 ( )
A.温室效应 B.氮的氧化物排放
C.白色污染 D.对臭氧层的破坏
查看答案和解析>>
科目: 来源:2010年福建省高三上学期第二次月考试卷化学试题 题型:选择题
用下图表示的一些物质或概念间的从属关系中不正确的是 ( )

|
|
X |
Y |
Z |
|
A |
甲烷 |
有机物 |
化合物 |
|
B |
空气 |
分散系 |
混合物 |
|
C |
酒精 |
含碳化合物 |
有机化合物 |
|
D |
Mn2O7 |
酸性氧化物 |
氧化物 |
查看答案和解析>>
科目: 来源:2010年福建省高三上学期第二次月考试卷化学试题 题型:选择题
下列化学用语书写正确的是( )
A.N2的结构式: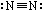 B.CO2的分子模型:
B.CO2的分子模型:
C.四氯化碳的电子式: D.氧离子结构示意图:
D.氧离子结构示意图: 
查看答案和解析>>
科目: 来源:2010年福建省高三上学期第二次月考试卷化学试题 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.标准状况下,11.2 L SO3所含的原子数为2NA
B.标准状况下,22.4L氧气和乙炔混合物所含的分子数为NA
C.0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA
D.46g NO2和N2O4的混合物所含的分子数为NA
查看答案和解析>>
科目: 来源:2010年福建省高三上学期第二次月考试卷化学试题 题型:选择题
下列各组离子在指定条件下一定不能大量共存的是 ( )
A.在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-
B.c (H+)=0.lmol·L-1的溶液中:Cu2+、A13+、SO42-、NO3-
C.能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2-
D.在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com