
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:选择题
下列关于有机物的说法错误的是
A.乙烯使溴水退色是因为发生了加成反应
B.糖类、油脂、蛋白质都可以水解
C.只用水就可以鉴别四氯化碳、苯和乙醇
D.石油分馏是物理变化、煤干馏是化学变化
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:选择题
氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法正确的是
A.Fe2+、Mg2+、Cl-、NO3-能大量共存于pH =0的溶液中
B.1L浓度为l mol·L-1的NH4Cl溶液中含有NA个NH4+
C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO
D.不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:选择题
在80℃时,某物质在2L的容器中发生化学反应,隔一段时间对该容器内的物质进行分析,得到如表数据:

则下列说法正确的是
A.该反应的方程式为2NO2 N2O4
N2O4
B.80s前该反应一定没有达到平衡状态
C.a的取值为0.56
D.20s到40s内用N2O4表示的反应速率为0.010mol·L-1·S-1
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:选择题
25 ℃时,在20 mL的盐酸中,逐滴加入0.2 mol·L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是
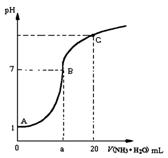
A.滴加前盐酸的物质的量浓度为0.1 mol·L-1
B.B点的横坐标a=10
C.A、B间的任一点,溶液都有c(Cl-)>c(NH4+)> c (H+)> c(OH-)
D.如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:填空题
(12分)运用相关原理,回答下列各小题:
Ⅰ.已知NaHSO4在水中的电离方程式为 NaHSO4=Na+ + H+ + SO42- 。
(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2 ;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.(1)工业上电解硫酸锌溶液可实现电解法炼锌(控制条件,使H+难放电、阳极电极不溶解)。写出相关的电解化学方程式: 。
(2)将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力。镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的 极发生 反应而损耗,铁受到保护。
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:填空题
(14分)CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则反应CO(g)+H2(g) +O2(g)=== H2O(g)+CO2(g)的△H= kJ·mol-1 。标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移 mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-→3CO2+H2O;则该电池的正极反应式是: 。
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K= ;此时在B点时容器的体积VB 10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是 。
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:实验题
(16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示:

已知:①王水是由1体积的浓硝酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
A.BaCl2 B.NaOH C.Na2SO4 D.HCl
(4)实验室利用下列装置和试剂制取少量氯化氢气体试剂:①浓硫酸 ②浓盐酸 ③食盐固体

若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
若选用试剂①②,则宜选择的装置是____________。
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:填空题
(8分)【化学-化学与技术】
电解原理在工业有广泛的应用。利用相关知识回答下面的问题。
(1)铝的阳极氧化:在进行电解以前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是 ,反应的离子方程式为 。铝的阳极氧化时,铝与电源的 极(填写正、负极)相连。
(2)电解原理的运用:在右图装置中,溶液的体积为100mL,开始时电解质溶液的浓度为0.1mol/L,工作一段时间后导线上通过0.001mol电子。若不考虑盐的水解和溶液体积的变化,则电解后溶液的pH值为____________。

(3)电镀是运用电解原理,在金属表面形成一薄层有抗腐蚀、抗磨损能力的金属镀膜的过程。例如:在铜片上电镀银时,电解原理是:采用AgNO3溶液为电解质,用 作阳极。而在实际的电镀工艺中,要求金属在镀件上的析出速率得到控制,使析出的镀层厚度均匀、光滑致密、与底层金属的附着力强。所以在铁件上电镀铜时,实际使用的电镀液是 。
A.FeCl2 B.CuCl2 C.K6[Cu(P2O7)2] D.CuSO4
查看答案和解析>>
科目: 来源:2010年山东省威海市高三第二次模拟考试(理科综合)化学部分 题型:填空题
(8分)【化学-物质结构与性质】
利用有关知识回答下列问题:
(1)B、F两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(2)CH4与 (写微粒符号)互为等电子体。
(3)写出元素Cu基态原子的电子排布式 。
(4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于 晶体(填晶体类型)。
(5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为 。
(6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com