
科目: 来源:2013届海南中学高一第二学期期末考试(2-20班)化学试卷 题型:选择题
羧酸和醇反应生成酯的相对分子质量为90,该反应的反应物是
A.CH3- -18OH和CH3CH2OH B.CH3-
-18OH和CH3CH2OH B.CH3- -18OH和CH3CH2-18OH
-18OH和CH3CH2-18OH
C.CH3 -18OH和CH3CH2-18OH
D.CH3
-18OH和CH3CH2-18OH
D.CH3 -18OH和CH3CH2OH
-18OH和CH3CH2OH
查看答案和解析>>
科目: 来源:2013届海南中学高一第二学期期末考试(2-20班)化学试卷 题型:填空题
(5分)在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小颗粒______________________;
(2)夏天的食品变霉,在冬天不易发生该现象
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢_____;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同______________________;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体________________。
查看答案和解析>>
科目: 来源:2013届海南中学高一第二学期期末考试(2-20班)化学试卷 题型:填空题
(9分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NH3 ,请回答:
(1)Na3N的电子式__________________,该化合物是由______________键形成。
(2)Na3N与水反应方程式为____________________________________________,该反应属___________________(填基本反应类型)反应。
(3)Na3N放入足量盐酸中生成_______种盐,其化学式为__________________。
(4)比较Na3N中两种粒子的半径:r(Na+)___r(N3-)(填“>”“=”或“<” )
查看答案和解析>>
科目: 来源:2013届海南中学高一第二学期期末考试(2-20班)化学试卷 题型:填空题
(15分)根据下列要求,从①H2O②CH2=CH2 ③CH3COOH④Na2CO3 ⑤HNO3 ⑥(C6H10O5)n⑦CH3CH2OH中选择恰当的反应物(用序号填写),并写出对应的化学方程式。
|
|
反应物 |
化学方程式 |
反应类型 |
|
(1)与苯发生取代反应 |
苯和______ |
|
|
|
(2)表示酒越陈越香的原理 |
⑦和______ |
|
|
|
(3)说明乙酸酸性比碳酸强 |
③和______ |
|
|
|
(4)咀嚼米饭时有甜味的原因 |
____和_____ |
|
|
查看答案和解析>>
科目: 来源:2013届海南中学高一第二学期期末考试(2-20班)化学试卷 题型:填空题
(9分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)写出A的电子式 。
(2) B、D分子中的官能团名称分别是 . 。
(3)写出下列反应的反应类型:①______________,②_______________。
(4)写出下列反应的化学方程式:
① ;
② 。
查看答案和解析>>
科目: 来源:2013届海南中学高一第二学期期末考试(2-20班)化学试卷 题型:填空题
(8分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
|
X |
Y |
|
|
|
Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
查看答案和解析>>
科目: 来源:2013届海南中学高一第二学期期末考试(2-20班)化学试卷 题型:实验题
(8分)用下图所示实验装置制取乙酸乙酯。回答以下问题:
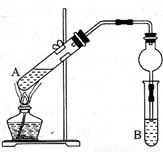
(1)在A试管中配置好体积比为3:2的乙醇和乙酸,加热至沸腾,很久都末有果香味液体生成,原因是
____________________________________________。
(2)B试管中所装溶液应为_________,乙酸乙酯生成后,将在该溶液的___________(填“上”或“下”)层,分离出产品所需的主要仪器是______________________。
(3)与教材采用的实验装置不同,这位老师采用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处,球形干燥管的作用有
①________________________________,②______________________________。
查看答案和解析>>
科目: 来源:2013届海南省高一下学期教学质量检测化学检测(三)(理) 题型:选择题
下列表示物质结构的化学用语或模型正确的是
A、CO2分子的球棍模型: B、乙烯的结构简式:CH2CH2
B、乙烯的结构简式:CH2CH2
C、 NH4Cl的电子式: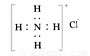 D、8个中子的碳原子符号:14C
D、8个中子的碳原子符号:14C
查看答案和解析>>
科目: 来源:2013届海南省高一下学期教学质量检测化学检测(三)(理) 题型:选择题
关于锂的结构和性质判断错误的是
①与水反应比钠剧烈 ②原子半径小于钠 ③有Li2O、Li2O2两种氧化物
④它的阳离子最外层电子数与钠的阳离子相同 ⑤它是还原剂
A、③⑤ B、①②③ C、①③④ D、①③
查看答案和解析>>
科目: 来源:2013届海南省高一下学期教学质量检测化学检测(三)(理) 题型:选择题
化学反应N2 + 3H2 === 2NH3 的能量变化如图所示,以下叙述正确的是

A、1/2 mol N2和3/2 mol H2转变为原子是放出能量a KJ
B、1mol N 和3mol H结合成1mol NH3(g)时放出热量b KJ
C、1mol NH3(l)转变为1mol NH3(g)时放出热量 c KJ
D、1/2 mol N2 和3/2 mol H2 反应生成1mol NH3(l)是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com