
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:选择题
在100g炭不完全燃烧所得气体中CO和CO2的体积比为1:2.已知:
C(s)+1/2O2(g)=CO(g);△H1=-110.35kJ/mol
CO(g)+1/2O2= CO2(g);△H2=-282.57kJ/mol
则与100g炭完全燃烧相比,损失的热量是
A、392.93kJ B、2489.42kJ C、784.92kJ D、3274.3kJ
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:选择题
可用下面示意图象表示的是

|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量钾、钠分别与水反应 |
H 2质量 |
钠 |
钾 |
|
B |
相同质量氨,在同一容器中 2NH3 |
氨气的转化率 |
500℃ |
400℃ |
|
C |
体积比1:3的N2,H2,在体积可变的恒压容器中,2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2 mol S02与l mol 02,在相同温度下2S02+02 |
S03物质的量 |
10atm |
2atm |
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:选择题
下列叙述正确的是
A.c(NH)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.0.2 mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2 溶液混合后,溶液的pH=1
D.0.2 mol·L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO)+c(OH-)
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:选择题
下列混合溶液中,各离子浓度的大小顺序正确的是
A、10mL0.1 mol·L-1氨水与10mL0.1 mol·L-1盐酸混合,c(Cl-) > c(NH4+)> c(OH-) > c(H+)
B、10mL0.1 mol·L-1NH4 Cl溶液与5mL0.2 mol·L-1NaOH溶液混合,c(Na+)= c(Cl-)> c(OH-) > c(H+)
C、10mL0.1 mol·L-1CH3COOH溶液与5mL0.2 mol·L-1NaOH溶液混合,c(Na+)= c(CH3COO-)> c(OH-) > c(H+)
D、10mL0.5 mol·L-1CH3COONa溶液与6mL1 mol·L-1盐酸混合,c(Cl-) > c(Na+)> c(OH-) > c(H+)
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:选择题
常温下,用 0.1000
mol·L NaOH溶液滴定
20.00mL0.1000 mol·L
NaOH溶液滴定
20.00mL0.1000 mol·L
 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中: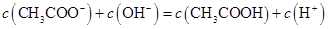
B.点②所示溶液中:
C.点③所示溶液中: 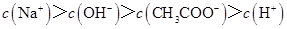
D.滴定过程中可能出现: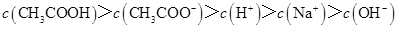
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:选择题
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.100
0 mol·L 的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L
的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L )为:
)为:
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4===8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008 889 B.0.080 00 C.0.120 0 D.0.240 0
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:实验题
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。
试回答下列问题:
(1)终点时锥形瓶中的溶液从 色变为 色。
(2)该小组在步骤①中的错误是 ,由此造成的测定
结果 (偏高、偏低或无影响)。
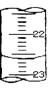
(3)上图,是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.50 |
25.40 |
|
第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol·L-1。
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:填空题
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用下图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
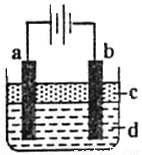
(1)a极材料为 ,a电极反应式为 。
(2)电解液d可以是 ,则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极
上看到的气泡外,另一明显的现象为 。
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:填空题
现有反应:CO(g)+ H2O(g)
 CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K_____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大小”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源:2012届浙江省高二下学期期中考试化学试卷 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA |
NaOH |
混合溶液的pH |
|
甲 |
[HA]=0.2 mol·L-1 |
[NaOH]=0.2 mol·L-1 |
pH=a |
|
乙 |
[HA]=c1 mol·L-1 |
[NaOH]=0.2 mol·L-1 |
pH=7 |
|
丙 |
[HA]=0.1 mol·L-1 |
[NaOH]=0.1 mol·L-1 |
pH=9 |
|
丁 |
pH=2 |
pH=12 |
pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?
(2)c1 (填“<”、“>”或“=”)0.2 mol·L-1。乙组实验中HA和NaOH溶液混合前,HA溶液中[A-]与NaOH溶液中[Na+]的关系是 (从下面选项中选择填空)
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ,其中,[A-]= mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前[HA] (填“<”、“>”或“=”)[NaOH], b 7(填“<”、“>”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com