
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:选择题
某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的 NaOH溶液中,由水电离出的c(H+)·c(OH-) = 10-22,则该探究小组在该温度下测得0.01mol/L的 NaOH溶液的pH值应为
A.13 B.12 C.10 D.11[来源:学&科&网Z&X&X&K]
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:选择题
PH=2的两种一元酸x和y,体积均为100ml,稀释过程中PH与溶液体积的关系如图所示,分别滴加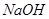 溶液(c=0.1
溶液(c=0.1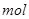 /L)至PH=7,消耗
/L)至PH=7,消耗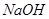 溶液的体积为Vx,Vy,则
溶液的体积为Vx,Vy,则
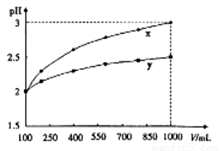
A、x为弱酸Vx<Vy B、x为强酸Vx>Vy C、y为强酸Vx>Vy D、y为弱酸Vx<Vy
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:选择题
在用标准 0.1000 mol/L的盐酸溶液滴定待测NaOH溶液的实验操作中下列说法正确的是
A、在滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶
B、两眼应时刻注视酸式滴定管内液面变化
C、在滴定终点时,待指示剂变色应立即读数,否则会产生误差
D、在加待测NaOH溶液时,锥形瓶应先用待测液润洗
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:填空题
已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:填空题
用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则:
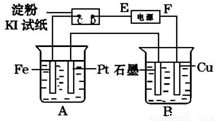
(1)电源的F端为_____________极。
(2)A中发生反应的化学方程式为________________。
(3)在B中观察到的现象是____,_________,_________
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,,B中析出硫酸钠晶体(Na2SO4﹒10H2O) ωg。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则①A溶液的pH为______________。
②电解前饱和Na2SO4溶液的质量分数为________________(列出算式即可。)
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:填空题
某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw= 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb= 。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb= 。
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:实验题
某学生用中和滴定法测定某烧碱的纯度。实验如下:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制成1000mL的溶液,除烧杯外,还需要的玻璃仪器有 。
(2)用标准 0.1000 mol/L的盐酸溶液滴定NaOH溶液的实验操作如下:
A.用碱式滴定管取稀NaOH溶液 20 mL,注入锥形瓶中,加入指示剂。B.用待测定的NaOH溶液润洗碱式滴定管。C.用蒸馏水洗干净滴定管。D.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3 cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。E.检查滴定管是否漏水。F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
(3)酸式滴定管用蒸馏水润洗后,未用标准液润洗,导致滴定结果(填“偏小”、“偏大”或“无影响”) ;酸式滴定管读数时,若先俯后仰,则结果会 。
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:填空题
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x=_________;
②若反应经2min达到平衡,平衡时C的浓度________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
查看答案和解析>>
科目: 来源:2012届浙江省台州市高二下学期六校期中联考化学试卷 题型:填空题
现有甲、乙两个容积相等的恒容密闭容器,向甲中通入6 mol A和2
mol B,向乙中通入1.5 mol
A、0.5 mol B和3 mol C,将两容器的温度恒定为770 K,使反应3A (g) +B (g)  xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
请回答下列问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x = ____________;若平衡时,甲、乙两容器中A的物质的量不相等,则x = ____________。
(2)平衡时,甲、乙两容器中A、B的物质的量之比是否相等?__________(填“相等”或“不相等”),平衡时甲中A的体积分数为________________。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com