
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:选择题
一定条件下,在密闭容器中,能表示X(g) + 2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成 mol X
mol X
⑤V(X)∶V(Y)∶V(Z) = 1∶2∶2
A.①②③ B.①④⑤ C.②③④ D.③④⑤
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:选择题
下列离子方程式的书写正确的是( )
A.SO2使酸性KMnO4褪色:5SO2 + 2MnO4-+ 2H2O = 5SO42-+ 2Mn2++ 4H+
B.Fe(OH)2与HNO3溶液的反应:Fe(OH)2 + 2H+= Fe2++ 2H2O
C.足量NaOH与磷酸二氢铵反应:OH-+ NH4+= NH3·H2O
D.将SO2通入BaCl2溶液中:SO2 + H2O + Ba2+= BaSO3↓+ 2H+
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:选择题
吸入人体内的O2有2%转化为活性氧(如 ),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3消除活性氧。下列说法中不正确的是( )
),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3消除活性氧。下列说法中不正确的是( )
A.Se为ⅣA族元素 B.消除活性氧时,Na2SeO3是还原剂
C.一定条件下,O2能置换出单质Se D.H2Se的稳定性比HBr弱
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:选择题
2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成NO和NO2气体,当Cu反应完毕时,共收集到气体1.12L(标况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol B.1 mol C.1.05 mol D.0.13 mol
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:选择题
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )

A.反应开始到10s,Z表示的反应速率为0.158moL/(L·s)
B.反应开始到l0s时,平均反应速率:
v(X) = v(Y) = 0.0395 mol/(L·s)
C.反应的化学方程式为:2Z(g)  X(g)+Y(g)
X(g)+Y(g)
D. l0 s后,该反应停止进行
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:选择题
在容积为672 mL的烧瓶中充满NO、NO2的混合气体,将其倒立在水槽里,去塞后通入280 mL氧气,反应恰好完成,且水充满烧瓶(气体体积都已合折为标准状况),下列有关叙述中正确的是( )
A.总反应:NO + NO2 + O2 + H2O = 2HNO3
B.总反应:4NO + 8NO2 + 5O2 + 6H2O = 12HNO3
C.生成HNO3浓度接近0.03 mol/L
D.生成HNO3浓度约0.45 mol/L
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:选择题
环境监测测定水中溶解氧的方法是①量取a mL水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH)塞好盖子,摇匀,使之完全反应;②测定:开塞后加适量H2SO4,使之生成I2,再用6 mol/L的Na2S2O3溶液和I2恰好完全反应,消耗3 V mL Na2S2O3溶液,有关方程式为:2Mn2++ O2 + 4OH-= 2MnO(OH)2(快)
MnO(OH)2 + 2I-+ 4H+= Mn2++ I2 +3H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
求:水中溶解氧的量(g/L为单位)( )
A.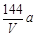 B.
B.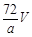 C.
C.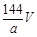 D.
D.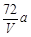
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:填空题
(10分) 按要求填空
(1) 配平下列化学方程式:
______P + ________FeO + _______CaO =_______Ca3(PO4)2 +_________Fe
(2) 制造光导纤维的材料是_________;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(3) 除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为__________________________________________。
(4) 检验SO42-所需要用的试剂__________________和__________________。
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:填空题
(10分) 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)V2O5是SO2与O2反应的催化剂,请写出该反应的方程式:
_____________________________________________________________________。
(2)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为_____________;生成SO3的化学反应速率为_________________。
(3)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
A.压缩体积,增大压强 B.降低温度
C.充入大量的氮气 D.仅增加SO2的浓度
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式
______________________________________________________。
查看答案和解析>>
科目: 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:填空题
(12分) 如下图所示,在一个烧瓶中充满气体A,打开①处的止水夹向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。

(1)请按要求填表回答打开②处的止水夹前烧瓶中所观察到的现象并按要求书写反应的化学方程式:

(2) 打开②处的止水夹后,烧瓶内剩余气体最多的是(填实验序号)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com