
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
向 Cr2 (SO4)3 的水溶液中加入NaOH溶液,当pH=4.6时开始出现Cr(OH)3 沉淀,随着pH的升高,沉淀增多,当pH≥13时,沉淀消失,出现亚铬酸根离子(CrO2-),其平衡关系:
Cr3+ + 3OH-Cr(OH)3 CrO2-+ H++H2O
(紫色) (灰绿色) (亮绿色)
向50mL 0.05 mol·L-1的Cr2(SO4)3 溶液中加入等体积1.0mol·L-1的 NaOH溶液,充分反应后,溶液中可观察到的现象为
A. 溶液为紫色 B. 溶液为亮绿色
C. 溶液中有灰绿色沉淀 D. 无法判断
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是

A. 红墨水柱两边的液面变化是左高右低
B. b试管中溶液pH值减小
C. 两试管中相同的电极反应式是: Fe-3e-=Fe3+
D. a试管中阳极反应式为:O2+2H2O-4e-=4OH-
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
下列叙述中,正确的是
A. 中和10mL 0.1 mol·L-1HAc与中和100mL 0.01 mol·L-1HAc所需NaOH的物质的量不同
B. 10mL 0.1 mol·L-1氨水与100mL 0.01 mol·L-1氨水,其OH-物质的量相同
C. 相同条件下,将pH值相同的盐酸和醋酸稀释相同的倍数,盐酸pH值变化较大
D. 锌分别与pH=3的盐酸和pH=3的醋酸溶液反应,起始反应速率盐酸较快
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
下列离子方程式书写错误的是
A.氧化铝溶于强碱溶液中:3H2O+Al2O3+2OH-=2Al(OH)4-
B.在苯酚钠溶液中通入CO2气体:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
C.用惰性电极电解硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.在海带中提取碘元素时,在滤液中加入适量的稀硫酸和双氧水:2H++2I-+H2O2=I2+2H2O
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
下列实验操作正确的是
A.纸层析法分离铁离子和铜离子的实验中,应将滤纸上的试样点浸入展开剂中
B.硝酸钾晶体的制备实验中,蒸发浓缩硝酸钠和氯化钾的混合溶液,氯化钠晶体析出后趁热过滤,承接滤液的烧杯应预先加蒸馏水,以防降温氯化钠溶液达饱和而析出
C.海带中碘元素的分离及检验的实验中,将海带灰用蒸馏水浸泡,煮沸2~3 min,取其浸取液,向其中加入四氯化碳萃取其中的碘
D.乙醇的脱水反应(制乙烯)实验中,反应的温度应控制在170℃,温度计的水银球应处于支管口处
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
在固定体积的密闭容器中,发生:N2(g)+3H2(g)2NH3(g) DH=-92.2 kJ·mo1-1 ,下图表示在时间t0~t7中反应速率与反应过程的曲线图,则容器内氨的百分含量最高的一段时间是(只改变单一的条件)

A. t0~t1 B. t2~t3 C. t4~t5 D. t6~t7
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
下列各溶液中,微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1NaHCO3溶液中: c (H2CO3) > c (CO32-)
B.0.1 mol·L-1Na2CO3溶液中:c (Na+)=2 c (CO32-)+ 2 c (HCO3-)+2c (H2CO3)
C.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合,其混合溶液中:
c (Cl-) > c (NH4+ ) > c (Na+ ) > c (OH-) >c (H+)
D.浓度均为0.1 mol·L-1的NH4Cl、CH3COONH4、NH4HCO3溶液的pH大小顺序:
pH (CH3COONH4) > pH (NH4HCO3) > pH (NH4Cl) *网
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:选择题
完全燃烧一定质量的无水甲醇生成CO2 和水蒸气放出热量为Q,已知为了完全吸收生成的CO2,消耗8mol·L-1NaOH溶液50mL,则完全燃烧1mol无水甲醇产生CO2气体和液态水放出的热量不可能是
A. 5Q B. 小于2.5Q C. 大于5Q D. 2.5Q ~5Q
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:填空题
(8分)已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题:
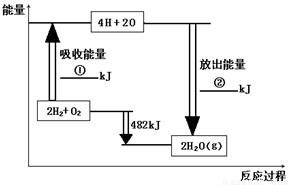
(1)分别写出①②的数值:
① ▲ ; ② ▲ 。
(2)生成H2O(g)中的1mol H-O键放出 ▲ kJ的能量。
(3)已知:H2O(l)= H2O(g) DH = +44 kJ·mol-1 ,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式: ▲ 。
查看答案和解析>>
科目: 来源:09-10年台州市高二下学期期末考试化学卷 题型:填空题
(11分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:N2H4+O2=N2+2H2O,若将此反应设计成如图所示的原电池装置,请回答:
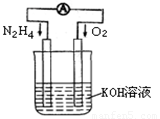
①负极反应式为: ▲ ;
②工作一段时间后正极附近溶液的pH变化为 ▲ (填“增大”“减小”或“不变”) ;高*考*资* ③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为 ▲ 。
(2)在25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2 混合溶液中逐滴加入氨水,首先生成 ▲ 沉淀(填化学式),生成该沉淀的离子方程式为 ▲ 。(已知25℃ Ksp[Mg (OH)2]=1.8×10-11,Ksp[Cu (OH)2]=2.2×10-20)。
(3)在25℃时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)= c (Cl-),则溶液显 ▲ 性(填“酸”“碱”或“中”),用含a的代数式表示NH3· H2O的电离常数kb= ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com