
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(10分)下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。A、C、E、G为单质,其中A、C、G为金属,E为气体。B为常见无色液体,L为红褐色固体,I的焰色反应呈紫色。常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质。
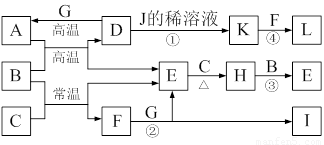
⑴A在元素周期表中的位置为 ▲ ,H的电子式为 ▲ 。
⑵写出有关反应的离子方程式:
反应①的离子方程式为 ▲ 。
反应②的离子方程式为 ▲ 。
⑶反应③中每生成1 mol E,转移电子的物质的量为 ▲ 。
查看答案和解析>>
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(10分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下:
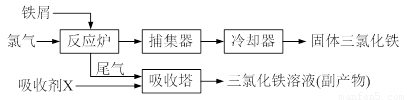
⑴取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片得红褐色氢氧化铁胶体,其离子方程式可表示为: ▲ ,胶体粒子的直径一般不超过 ▲ 。
⑵吸收塔中吸收剂X是 ▲ 。
⑶温度超过673 K,捕集器中的物质相对分子质量为325,该物质的分子式为 ▲ 。
⑷通常用碘量法测定FeCl3的质量分数:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去V mL。则样品中氯化铁的质量分数为: ▲ 。
查看答案和解析>>
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等。A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道。D和E原子的第一至第四电离能如下表所示:
|
电离能/ kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
D |
738 |
1451 |
7733 |
10540 |
|
E |
578 |
1817 |
2745 |
11578 |
⑴A、B、C三种元素的电负性最大的是 ▲ (填写元素符号),D、E两元素中D的第一电离能较大的原因是 ▲ 。
⑵F基态原子的核外电子排布式是 ▲ ;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于 ▲ 光谱(填“吸收”或“发射”)。
⑶根据等电子原理,写出AB+的电子式: ▲ 。
⑷已知:F3+可形成配位数为6的配合物。组成为FCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 ▲ 。
A.[CrCl (H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3] ·3H2O
查看答案和解析>>
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表)。

回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于 ▲ (选填“极性分子”或“非极性分子”)。
⑵在水分子中,O原子上的价层电子对数为 ▲ 。
⑶N2O4分子结构式为 ,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为 ▲ 。
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
查看答案和解析>>
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
|
氧化物 |
MgO |
CaO |
SrO |
BaO |
|
晶格能/ kJ·mol-1 |
3791 |
3410 |
3223 |
3054 |
①将上表中四种氧化物的共熔物冷却,首先析出的是 ▲ 。
②碳酸盐的热分解示意图如下图。两种碳酸盐的热分解温度CaCO3 ▲ SrCO3(填“高于”或“低于”)

⑵已知NH3·H2O的电离方程式为NH3·H2O NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
①2NH3·H2O的晶体类型为 ▲ 。
②NH3极易溶于水,其主要原因是 ▲ 。
⑶CaF2的晶体结构如图所示。
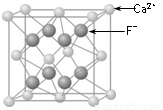
①CaF2晶体中钙离子的配位数是 ▲ 。
②一个CaF2晶胞中包含 ▲ 个钙离子。
查看答案和解析>>
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)高温超导材料是科学家研究的重点物质之一。
⑴科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如下左图所示。该富勒烯化合物中的K原子和C60分子的个数比为 ▲ 。
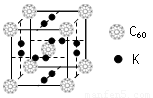

⑵某同学画出的C的核外电子排布(轨道表示式)如上右图所示,该电子排布图(轨道表示式)违背了 ▲ ,请你画出正确的电子排布图(轨道表示式) ▲ 。
⑶金属钾采用的是下列 ▲ (填字母代号)堆积方式。
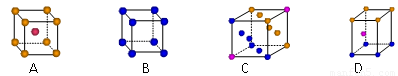
⑷富勒烯(C60)的结构如图。
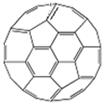
①1 mol C60分子中σ键的数目为 ▲ 。
②已知:金刚石中的C-C的键长为154.45 pm,C60中C-C键长为145~140 pm。有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由: ▲ 。
查看答案和解析>>
科目: 来源:09-10年宜昌市高一三月联考化学卷 题型:选择题
设NA代表阿伏加德罗常数的值,下列说法不正确的是
A.阿伏加德罗常数NA的数值是0.012kg12 C 中所含的原子数
B.标准状况下,22.4LCl2与过量Fe反应时转移电子数目为2NA
C.标况下,22.4L SO2所含的分子数目约为NA
D.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA
查看答案和解析>>
科目: 来源:09-10年宜昌市高一三月联考化学卷 题型:选择题
在下列强酸性溶液中,能大量共存的是
A.Ca2+、K+、HCO3—、OH— B.Na+、ClO—、H+、MnO4—
C.Fe3+、Mg2+、Cl—、SCN— D.K+、NH4+、SO42—、Cl—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com