
科目: 来源:福建省厦门外国语学校2010-2011学年高三第一次月考 题型:计算题
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应
2SO2(g)+O2(g)  2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040
mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度
(C)增大压强 (D)减小压强
(E)加入催化剂 (G)移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为________________________________________________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是______________________。
查看答案和解析>>
科目: 来源:福建省厦门外国语学校2010-2011学年高三第一次月考 题型:填空题
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
①写出步骤(I)反应的化学方程式:
②写出步骤(III)反应的离子方程式:
(2)还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
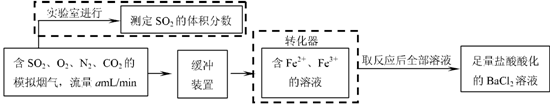
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填
序号) 。(参考:还原性SO2 > I- >Br->Cl-)
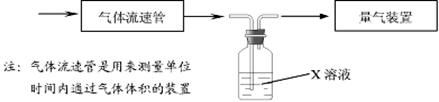
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测
定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+ Sx 、
Sx 、
CO+ Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+ Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇(CH3OH),NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.由mXa+与nYb-得,m+a = n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
下表中评价合理的是
|
选项 |
化学反应及其离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应: 2Fe3O4+18H+=6Fe3++H2↑+8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸: CO32-+2H+=CO2↑+H2O |
错误,碳酸镁不应该写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-=BaSO4↓ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1:2 |
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也不能使酸性高锰酸钾溶液褪色
D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
用NA代表阿伏加德罗常数,下列表述正确的是
A.1L 0.5 mol·L-1 CuCl2溶液中含有Cu2+的个数为0.5NA
B.标况下,22.4L辛烷完全燃烧生成二氧化碳分子为8NA
C.1mol Na2O和1mol Na2O2晶体中离子总数均为3NA
D.1mol羟基中电子数为10 NA
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O →NaOH +NH3 ,CaH2+H2O →Ca(OH)2 +H2。有关它们的叙述:①离子半径:Na+>N3->H+ ;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.②③④⑤ B.①③⑤ C.②④ D.③
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
 在某体积固定的密闭容器中进行如下可逆反应:A(g)+B(g)
在某体积固定的密闭容器中进行如下可逆反应:A(g)+B(g) 2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
A.此反应的正反应是吸热反应
B.反应在T1温度时达到平衡
C.T3温度时正反应速率大于逆反应速率
D.T3温度时正反应速率大于T1温度时正反应速率
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
查看答案和解析>>
科目: 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:单选题
25°C时,下列关于分别由等体积0.1mol/L的2种溶液混合而成的溶液的说法中,不正确的是
A.Ba(OH)2溶液与Na2SO4溶液:pH=13
B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.Na2CO3溶液与NaOH溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+)
D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com