
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:多选题
已知下列两个气态物质之间的反应:
C2H2(g)+H2(g)C2H4(g)……①,2CH4(g) C2H4(g)+2H2(g)……②。
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g) CH4(g) ;ΔH=-Q1……Ⅰ
C(s)+H2(g) C2H2(g);ΔH=-Q2……Ⅱ
C(s)+H2(g) C2H4(g);ΔH=-Q3 ……Ⅲ(Q1、Q2、Q3均为正值),“Q值”大小比较正确的是
A.Q1>Q3>Q2 B.Q1>Q2>Q3 C.Q2>Q1>Q3 D.Q3>Q1>Q2
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:多选题
下列说法不正确的是
A.29.0g 2CaSO4·H2O晶体中结晶水的数目为0.1NA
B.常温下,1molNaHCO3投入足量稀盐酸中,待反应结束后,可逸出NA个CO2分子
C.用惰性电极电解500 mL饱和氯化钠溶液时,若溶液的pH变为13时,则电极上转移的电子数目约为3.01×1022(忽略溶液的体积变化,忽略电极产物间的反应)
D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:多选题
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。
|

下列说法不正确的是
A.5-FAM转变为5-CFDA属于取代反应
B.5-FAM的分子式为C21H12O7
C.5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,消耗NaOH 物质的量相同
D.实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:多选题
用酸性氢氧燃料电池电解苦卤水 (含Cl―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是

A.电池工作时,正极反应式为:O2 +2 H2O + 4e—=4 OH―
B.电解时,a 电极周围首先放电的是Br―而不是Cl―,说明相同条件时前者的氧化性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.若忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:多选题
下列说法正确的是
A.相同温度下,0.6mol/L氨水溶液与0.3mol/L氨水溶液中c(OH—)之比是2:1
B.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+)
C.25℃时,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:多选题
已知可逆反应X(g)+Y(g) Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
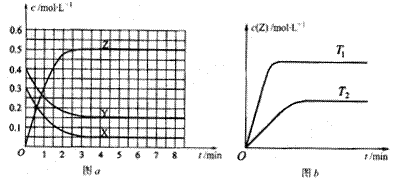
A.反应时各物质的反应速率大小关系为:2v(X)=2v(Y)=v(Z)
B.图a中反应达到平衡时,Y的转化率为37.5%
C.T0℃时,该反应的平衡常数为33.3
D.该反应的正反应是放热反应
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:填空题
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:


请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是 。
(2)参照右图溶解度曲线,得到的固体A的主要成分是 (填化学式)。
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
|
化学式 |
BaCO3 |
BaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
8.1×10一9 |
1.08×10一10 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
【设计除杂过程】

① 已知试剂B是K2CO3溶液,则混合液A的主要成分是 (填化学式)。
【获取纯净氯化钾】
②对溶液B加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。
③将溶液C倒入 蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
【问题讨论】
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为 。
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:填空题
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料来生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3
+7KCl+12H2O,
12Na2CrO4+3Fe2O3
+7KCl+12H2O,

试回答下列问题:
⑴ 反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
⑵ NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
⑶ 作③的目的是什么,用简要的文字说明: 。
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
② 断达到滴定终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:填空题
常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40 mL,溶液的pH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如右下图所示:
 回答下列问题:
回答下列问题:
(1)在同一溶液中,H2CO3、HCO3-、 CO32- (填:“能”或“不能”)大量共存。
(2)当pH=7时,溶液中各种离子其物质的量浓度的大小关系是: _。
 (3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(4)若将0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合,则混合后的溶液中c(CO32-) c(HCO3-)((填“大于”、“小于”或“等于”)。溶液中c(OH-)—c(H+)= [用 c(HCO3-)、 c(H2CO3)、c(CO32- )的关系式表示]
查看答案和解析>>
科目: 来源:江苏省南通市通州区2010届高三联考试卷 题型:填空题
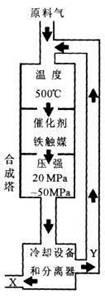
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如右图所示。
①合成氨条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学反应速率及化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
②改变反应条件,平衡会发生移动。压强增大,平衡常数K (填“增大”“减小”“不变”)
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的数目为 。
(3) 最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极电极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com