
科目: 来源:江苏省东台市2010-2011学年高一上学期期未考试化学试题 题型:013
|
在一定温度和压强下,气体体积主要取决于 | |
| [ ] | |
A. |
气体分子间的平均距离 |
B. |
气体分子微粒大小 |
C. |
气体分子数目的多少 |
D. |
气体分子式量的大小 |
查看答案和解析>>
科目: 来源:江苏省东台市2010-2011学年高一上学期期未考试化学试题 题型:013
|
等质量的①CH4、②H2、③HCl、④SO2,在标况下体积由大到小顺序是 | |
| [ ] | |
A. |
②>①>③>④ |
B. |
④>③>①>② |
C. |
③>②>④>① |
D. |
①>④>②>③ |
查看答案和解析>>
科目: 来源:江苏省东台市2010-2011学年高一上学期期未考试化学试题 题型:013
|
同温同压下,1 mol O2和36.5 g HCl气体的体积相比,前者和后者的大小关系是 | |
| [ ] | |
A. |
大于 |
B. |
等于 |
C. |
小于 |
D. |
不能肯定 |
查看答案和解析>>
科目: 来源:江苏省东台市2010-2011学年高一上学期期未考试化学试题 题型:013
|
下列反应中属于氧化还原反应的是 | |
| [ ] | |
A. |
CO2+H2O |
B. |
H2CO3 |
C. |
CaCO3+2HCl |
D. |
CO2+C |
查看答案和解析>>
科目: 来源:江苏省东台市2010-2011学年高一上学期期未考试化学试题 题型:013
|
下列物质属于容易导电的单质是 | |
| [ ] | |
A. |
熔融的NaCl |
B. |
KNO3溶液 |
C. |
Na |
D. |
乙醇 |
查看答案和解析>>
科目: 来源:宁夏银川一中2010-2011学年高二上学期期末考试化学试题 题型:013
|
放热反应CO(g)+H2O(g) | |
| [ ] | |
A. |
K 2和K1的单位均为mol/L |
B. |
K 2<K1 |
C. |
c 2(CO)>c2(H2O) |
D. |
c 1(CO)>c2(CO) |
查看答案和解析>>
科目: 来源:宁夏银川一中2010-2011学年高二上学期期末考试化学试题 题型:013
|
COCl2(g) ①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是 | |
| [ ] | |
A. |
①②④ |
B. |
①④⑥ |
C. |
②③⑥ |
D. |
③⑤⑥ |
查看答案和解析>>
科目: 来源:宁夏银川一中2010-2011学年高二上学期期末考试化学试题 题型:013
|
一定条件下,在可变容积的密闭容器中进行下列可逆反应 S2Cl2(l)+Cl2(g)=2SCl2(l) ΔH=-51.16 kJ/mol 浅黄色 鲜红色 下列说法正确的是 | |
| [ ] | |
A. |
达到平衡时,抽出少量氯气,反应混合液颜色变浅 |
B. |
单位时间内生成2n mol S2Cl2,同时生成n mol SCl2时,平衡向逆反应方向移动 |
C. |
达到平衡时,降低温度,混合液的颜色将变浅 |
D. |
单位时间内有n mol Cl2被还原,同时氧化生成n mol Cl2时,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源:宁夏银川一中2010-2011学年高二上学期期末考试化学试题 题型:013
|
对于 A2+3B2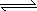 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
| |
| [ ] | |
A. |
v (B2)=0.8 mol/(L·s); |
B. |
v (A2)=0.4 mol/(L·s); |
C. |
v (C)=0.6 mol/(L·s); |
D. |
v (B2)=4.2 mol/(L·min). |
查看答案和解析>>
科目: 来源:宁夏银川一中2010-2011学年高二上学期期末考试化学试题 题型:013
|
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律.盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得.已知7.2 g碳在12.8 g的氧气中燃烧,至反应物耗尽,放出x kJ热量.已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为 | |
| [ ] | |
A. |
-y kJ·mol-1 |
B. |
-(10x-y)kJ·mol-1 |
C. |
-(5x-0.5y)kJ·mol-1 |
D. |
-(2.5x-0.5y)kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com