
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
利用太阳能的方法之一,是将装有芒硝的密闭塑料管安装在房屋的外墙内,当太阳照射时,它能把太阳能转化为化学能,达到蓄热作用,使室内保持较低温度;晚上它能将化学能转化为热能放出,使室内保持温暖,这种作用是利用________反应(用化学方程式表示).
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
据报导把APOLLO送上太空的燃料是肼(N2H4),氧化剂是N2O4.
(1)写出肼的结构式________
(2)升空开始时,可看到有红棕色气体,此气体是________,产生的原因为________.
(3)肼燃烧的化学方程式是________
(4)选肼作燃料和N2O4作氧化剂的优点是________.
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
在溶液中进行某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
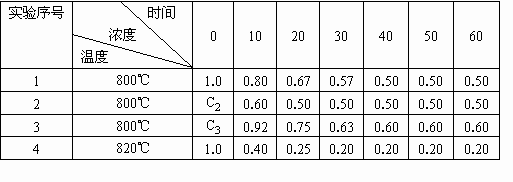
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率(VA)为________mol/(L·min).
(2)在实验2,A的初始浓度C2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是________.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1(填“>”、“=”、“<”),且C3________1.0mol/L(填“>”、“=”、“<”)
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热).理由是________.
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为________;
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题:

(1)同主族内不同元素的E值变化的特点是________,各主族中E值的这种变化特点体现了元素性质的________的变化规律.
(2)同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系式中正确的是________;(填编号,多选倒扣分)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________;
(4)10号元素E值较大的原因是________.
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C都能生成气态非极性分子的化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答:
(1)A为________元素(填名称,下同),B为________元素,C为________元素,D为________元素,E为________元素;
(2)C元素在周期表中属第________周期,________族元素,原子的电子排布式________;
(3)D与B形成的化合物的电子式________,属________晶体;
(4)C与E形成的化合物的电子式为________和________,属________晶体.
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1:Fe(s)+H2O
FeO(s)+CO(g)的平衡常数为K1:Fe(s)+H2O FeO(s)+H2(g)的平衡常数为K2.在不同温度时,K1、K2值如表中所示:
FeO(s)+H2(g)的平衡常数为K2.在不同温度时,K1、K2值如表中所示:

(1)反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3与K1和K2的关系为________;
CO(g)+H2O(g)的平衡常数K3与K1和K2的关系为________;
(2)973K和1173K时的K3的数值分别为________,________;
(3)(1)中的反应是________(填“吸热”或“放热”).
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
已知25℃时几种物质的电离度(溶液的浓度为0.1mol/L)如下表:

(1)25℃时,0.1mol/L上述几种溶液中[H+]由大到小的顺序是________;
(2)25℃时,pH值相同的上述几种溶液中物质的量浓度由大到小的顺序是________;
(3)25℃时,将足量Zn粉放入等体积、pH=1的上述溶液中,产生H2的体积(同温同压下)由大到小的顺序是________;
(4)25℃时,0.1mol/L H2SO4溶液的HSO4-的电离度小于NaHSO4溶液中HSO4-的电离度的原因是________.
查看答案和解析>>
科目: 来源:2004全国各省市高考模拟试题汇编·化学 题型:022
在热的稀H2SO4溶液中,溶解了11.4克FeSO4,当加入50mL 0.5mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+,KNO3也完全反应,并有NxOy氮氧化物逸出,反应如下:
( )FeSO4+( )KNO3+( )H2SO4→
( )K2SO4+( )Fe2(SO4)3+( )NxOy+( )H2O
(1)推算出x=________,y=________.
(2)配平该化学方程式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com