
科目: 来源: 题型:022
体积相同,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粉反应,开始时产生氢气的速率________,充分反应后产生氢气的量________(相同,醋酸的多,盐酸的多)。原因________。
查看答案和解析>>
科目: 来源: 题型:022
pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,恰好反应生成正盐,混合溶液的pH=8。
(1)反应所生成的正盐的化学式为________。
(2)该盐中________离子一定能水解,其水解的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:022
在400mL、0.5mol×L-1NaOH溶液里,通入H2S并充分反应后,将所得溶液小心蒸发,得不含结晶水白色固体yg,通入H2S为xmol,若x取值不同,则有下列几种情况:
(1)反应方程式为________,y=________。
(2)当0<x<0.1时,白色固体为________,y=________。
(3)当x=0.1时,白色固体为________,y________。
(4)当0.1<x<0.2时,白色固体为________,y________。
查看答案和解析>>
科目: 来源: 题型:022
在醋酸溶液中存在着电离平衡:
CH3COOHƒCH3COO-+H+
按表中要求填写有关空格:
加入固体 电离平衡移动方向 溶液中c(H+)变化
少量固体KOH
固体醋酸钠
同浓度的醋酸
少量盐酸溶液
查看答案和解析>>
科目: 来源: 题型:022
盐酸和醋酸的电离方程式分别是①________,若它们的浓度为0.1mol×L-1,在溶液导电性实验中,发光较亮的灯泡中的电流一定是通过②________的。0.1mol×L-1盐酸50mL和0.1mol×L-1醋酸溶液50mL中各投入0.5g锌粉,放出氢气速度大的是③________。最后在相同状况下放出氢气体积④________多。发生反应的离子方程式________分别是⑤________。
查看答案和解析>>
科目: 来源: 题型:022
化合物SOCl2是一种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式________。
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3×6H2O混合共热,可得到无水AlCl3,其原因是________。
查看答案和解析>>
科目: 来源: 题型:022
将水稻和番茄分别培养在含有相同浓度的Ca(NO3)2的中性营养液中,并在其中滴入几滴酚酞溶液。以试验开始时溶液中的NO3-和Ca2+的浓度值为100%,一段时间后测知两份营养液中Ca2+和NO3-浓度的百分比变化如图所示。
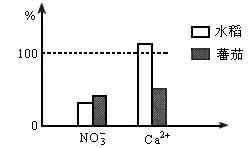
请根据以上结果分析:
(1)NO3-和Ca2+浓度下降的原因是________。水稻的营养液中Ca2+浓度升高的原因是________。
(2)植物对NO3-的吸收多于Ca2+,其原因是________。
(3)请你分析实验结束后两盆培养基中溶液的颜色变化,并写出引起该变化的化学方程式。
查看答案和解析>>
科目: 来源: 题型:022
为了测定固体烧碱中NaOH的质量分数w/(NaOH)是否在80%±2%的范围内(设烧碱中的杂质不与硫酸反应),取mg样品配制成500mL溶液,取出VmL的烧碱溶液用0.2000mol×L-1H2SO4标准溶液滴定。若要使到达滴定终点时,所滴入的0.2000mol×L-1H2SO4溶液的体积在数值上(单位为mL)恰好等于100w(NaOH)的![]() ,试求:
,试求:
(1)应取待测液的体积(单位为mL)是________。
(2)若希望取用20.0mL待测液用于滴定,所取的样品质量mg是________。
(3)在题设条件下,滴入的标准H2SO4溶液在________范围内,固体烧碱才算合格。
查看答案和解析>>
科目: 来源: 题型:022
反应N2+3H2ƒ2NH3在密闭容器中进行达到平衡,平衡时c(N2)=3.5mol×L-1,c(H2)=11mol×L-1,c(NH3)=5mol×L-1。求:
(1)N2和H2的起始浓度。
(2)N2的转化率。
(3)平衡时压强为开始时压强的百分之几。
(4)平衡时NH3占总体积的体积分数。
(5)增加NH3的产量应采取什么措施?
查看答案和解析>>
科目: 来源: 题型:022
工业上用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,先把铜屑在空气中灼烧,再与用等体积水稀释的HNO3反应来制取Cu(NO3)2,试回答以下问题。
(1)为什么不宜用铜屑直接与硝酸反应来制取硝酸铜?浓硝酸用等体积水稀释的目的是什么?
(2)如何制得硝酸铜晶体?
(3)反应后的尾气为什么必须处理?应该怎样处理?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com