
科目: 来源:高考三人行 化学 题型:022
某无色透明溶液与金属铝反应放出H2.试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、![]() 、
、![]() 、
、![]() 、OH-、
、OH-、![]() ,何者能存在于此溶液中?
,何者能存在于此溶液中?
(1)当生成Al3+时,可能存在________.
(2)当生成![]() 时,可能存在________.
时,可能存在________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
点燃的镁条可以像在CO2中那样在SO2中继续燃烧,但反应比镁和CO2反应更为剧烈.反应结束后,在盛SO2的广口瓶中可能存在的生成物是(写化学式)________,反应的化学方程式是________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
已知25℃时0.1mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.你认为上述两种解释中________(填“甲”或“乙”)正确.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L的醋酸溶液中加入少量下列物质中________(填写编号),然后测定溶液的pH.
A.固体CH3COOK
B.固体CH3COONH4
C.气体NH3
D.固体NaHCO3
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”、“减小”或“不变).(已知25℃时,NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5)
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
(1)在常温下,某硫酸和硫酸铝两种溶液的pH都是3,那么硫酸中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的________倍.
(2)在常温下,设某pH的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正数),那么a和b之间满足的数量关系是(用一个等式和一个不等式表示)________,________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
取NaOH、Na2CO3的混合物W g溶于水中,加入酚酞作指示剂,以物质的量浓度为m mol·L-1的盐酸滴定,耗用V1 L时酚酞变为粉红色,此时发生的化学反应方程式为(1)________;若最初以甲基橙作指示剂,当耗用V2 L盐酸时甲基橙为橙色,此时发生的化学反应方程式:(2)________.由此计算混合物中NaOH的质量分数为________,Na2CO3的质量分数为________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
工业制碱纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 ①
NH4HCO3+NaCl(饱和)=HaHCO3↓+NH4Cl ②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.
请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是________.
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
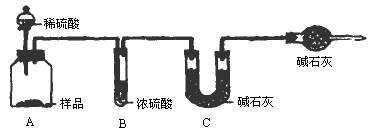
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.52g.
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2NaCl+2H2O+CO2↑).完成三次平行实验后,消耗盐酸体积的平均值为30.00mL.
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.请分析、计算后填表:

查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
将水稻和番茄分别培养在含有相同浓度的Ca(NO3)2的中性营养液中,并在其中滴入几滴酚酞溶液.以试验开始时溶液中的NO3-和Ca2+离子的浓度值为100%,一段时间后,测得两份营养液中时Ca2+和NO3-离子浓度的百分比变化如下表:

请根据以上结果分析:
(1)NO3-和Ca2+浓度下降的原因是________,而水稻的营养液中Ca2+浓度升高的原因是________.
(2)植物对NO3-多于对Ca2+的吸收,原因是________.
(3)请你分析实验结束后,两盆培养基中溶液的颜色变化________,并写出引起该变化的化学方程式________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
有一学生在实验室测某溶液的pH.实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测.
(1)该学生的操作是________(填“正确的”或“错误的”,其理由是________.
(2)如不正确请说明理由,同时请分析是否一定有误差?答:________.
(3)若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是________,原因是________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1溶液中水的电离程度小于A2溶液中水的电离程度,B1溶液中水的电离程度小于B2溶液中水的电离程度:
(1)写出化学式A1________A2________B1________B2________.
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的H+的物质的量浓度之比为________.
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是________.
(4)若B1、B2两溶液的pH=5,则两溶液中水电离出的H+的物质的量浓度之比为________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
常温下将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液.判断:
(1)溶液中共有________种微粒.
(2)溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是________和________.
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com