
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
元素A的氢化物有10个电子,A的最高价氧化物B和少量烧碱溶液反应生成盐C,取C的固体加热生成一种新盐D和气体E.
(1)当E为单质时,A为________,B为________,C为________,D为________,E为________.
(2)当E为混合物时,A为________,B为________,C为________,D为________,E为________.
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易燃物二氧化氯.其变化可表述为:
![]() KClO3+
KClO3+![]() HCl(浓)
HCl(浓)![]()
![]() KCl+
KCl+![]() ClO2+
ClO2+![]() Cl2+
Cl2+![]()
![]()
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内);
(2)浓盐酸在反应中显示出来的性质是________(填写编号,多选倒扣)
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1 mol Cl2则转移的电子的物质的量为________ mol
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的________倍.
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
Cu和Mg的合金4.6g完全溶于HNO3中,若反应中HNO3被还原只产生4480 mL NO2和336 mL N2O4气体(标况下)在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为________ g。
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
设在标准状况下做下列实验:
实验Ⅰ:将盛满氨气的容器,倒立在水中,反应后水面上升至容器几乎完全充满.
实验Ⅱ:将盛满NO2的容器,倒立在水中,反应后水面上升,最后水充满容器的2/3.
实验Ⅲ:将盛满NO2和O2的容器,倒立在水中,反应后,水几乎全充满容器.
试分析上述三个实验,各容器内形成的溶液,其物质的量浓度数值关系,正确的是________(填序号)
(1)Ⅰ中的大于Ⅱ中的
(2)Ⅲ中的最大
(3)Ⅰ中的等于Ⅱ中的
(4)Ⅲ中的最小
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
A、B、C、D是四种短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物E,1 mol该化合物含有42 mol电子;B原子的最外层电子数是次外层电子数的3倍;C元素是植物生长的营养元素之一,原子的最外层电子数是内层电子数的一半;D原子核内没有中子.
(1)A、B、C、D四种元素的名称及E的化学式为:A________,B________,C________,D________,E________
(2)A、C元素气态氢化物的稳定性为________<________(用化学式回答)
(3)用A、B、C、D四种元素可组成三种盐,写出它们的化学式:________,________,________.
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
一无色气体,可能是由CO2,HCl,NH3,NO2,NO,H2中的一种或几种所组成.将此无色气体通过盛有浓硫酸的洗气瓶.发现气体减少一部分体积.继续通过装有固体Na2O2的干燥管,发现从干燥管出气管出来的气体颜色显红棕色,再将该气体通入盛满水倒立于水槽的试管内,最后试管里仍为一满试管液体.由此我们认为:①原气体一定含有________,一定不会有________;②由最终结果可知原气体中________气体的体积比为________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
X、Y、Z三种元素位于周期表前20号元素之中.
已知:①XY2加水生成Y2Z2和化合物D;
②X的氧化物加水也生成D;
③Y的氧化物有两种.
请填空:(1)X、Y、Z的元素符号为X________,Y________,Z________.
(2)反应①的化学方程式为________.
(3)反应②的化学方程式为________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
电池在人们的日常生活,工农业生产、教学科研等各个方面具有广泛的应用.电池按不同的划分标准可以划分为不同的种类.应用最广泛的是电化学电池.
(1)电化学电池能够把________能转化为________能.电化学电池的工作原理是溶液中________的定向移动和电极上的________.
(2)下列电化学电池的正、负极材料易造成环境污染的是________.
①锂电池
②锌锰电池
③镉镍电池
④燃料电池
(3)锂电池的电压高,单个电池的电压3.6V.锂电池的正板材料是锂的过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳材料.锂在元素周期表中位于第________周期,第________主族.
(4)以甲烷、氧气和氢氧化钠溶液组成的燃料电池,其负极的电极反应为________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
如图所示装置为接触法制硫酸的流程图之一.试回答下列问题:
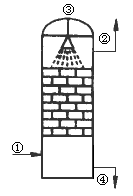
(1)该设备的名称是________,在该设备中进行的化学反应是________.
(2)图中标号处通入或放出的物质是:①________,②________,③________.
(3)设备中用H2SO4质量分数为98.3%的硫酸吸收SO3的原因是________.
(4)在④处是20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为20%),若要稀释制成98%H2SO4,则发烟硫酸与所用水的质量之比应为________.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:022
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
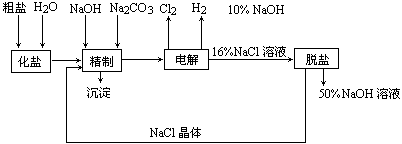
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的方程式为________.与电源负极相连的电极附近溶液pH值________.(填:不变、升高或降低)
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为________.
(3)如果粗盐中![]() 离子含量较高,必须添加钡试剂除去
离子含量较高,必须添加钡试剂除去![]() ,该试剂可以是________.
,该试剂可以是________.
a.Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却________(填写操作名称)除去NaCl.
(5)在用阳离子交换膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分反应,产物最终仅有NaClO和H2,相应的化学反应方程式为________、________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com