
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
将两种黑色的金属氧化物组成的混合物A分成三等分,按下图所示进行实验:

(1)写出三种气体的分子式:B________,C________,D________
(2)写出步骤②的化学方程式________________
查看答案和解析>>
科目: 来源: 题型:022
实验室里通常用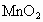 与浓盐酸反应制取氯气,其反应的化学方程式为:
与浓盐酸反应制取氯气,其反应的化学方程式为:
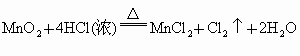
为进行有关氯气的性质实验,需要4瓶容积为100mL的氯气。(室温下,氯气的密度为2.91g/L。)
(1)制取4瓶氯气,理论上需要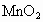 固体的质量是多少?(浓盐酸过量,并可以补充。)
固体的质量是多少?(浓盐酸过量,并可以补充。)
(2)实际称量的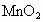 固体的质量必须适当多于理论量,主要原因是什么?
固体的质量必须适当多于理论量,主要原因是什么?
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
已知25℃时,0.1 mol/L醋酸溶液的pH约为3.向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大.对上述现象有两种不同解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大,你认为上述两种解释中________(“甲”或“乙”)正确.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L醋酸溶液中加入少量下列物质________(填写编号),然后测定溶液的pH.
A.固体CH3COOK
B.固体CH3COONH4
C.气体NH3
D.固体NaHCO3
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”、“减小”或“不变”).
(已知:25℃时0.1 mol/L氨水的电离度为1.3%,0.1 mol/L醋酸的电离度为1.3%,且电离度=![]() ×100%)
×100%)
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
25℃时,物质的量浓度相等的CH3COOH和NH3·H2O的稀溶液,两者pH之和为14.有一种并非常实用的酸碱指示剂,是中性红和次甲基在酒精中的混合溶液,称为“中性红![]() 次甲基蓝混合指示剂”,它恰好能在pH=7时在溶液中显蓝色,在酸溶液中呈紫色(蓝紫),在碱性溶液中呈绿色.
次甲基蓝混合指示剂”,它恰好能在pH=7时在溶液中显蓝色,在酸溶液中呈紫色(蓝紫),在碱性溶液中呈绿色.
(1)已知0.05 mol/L NH4Cl溶液的pH=5.3,试推断0.05 mol/L CH3COONa溶液的pH为________.
(2)用NaOH标准溶液(准确浓度接近0.1 mol/L)测定约0.1 mol/L的CH3COOH溶液准确浓度的实验方案中,试回答:①中性红![]() 次甲基蓝混合指示剂能否用于本实验的滴定?说明理由.________
次甲基蓝混合指示剂能否用于本实验的滴定?说明理由.________
②常用的酸碱指示剂中________适用于本实验的滴定,判断滴定终点的方法是________.
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
取含有“惰性”杂质的NaOH,Na2CO3混合物W g,溶于水中,加酚酞指示剂,用物质的量浓度为M mol/L的盐酸滴定,耗用V1 L盐酸时酚酞变为无色,此时反应的化学方程式是________.再加甲基橙指示剂,用盐酸继续滴定,当耗用V2 L盐酸时,甲基橙变为橙色,此时的化学方程式为________.混合物中NaOH的质量分数为________,Na2CO3的质量分数为________.
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
设水的电离平衡线如图所示.

(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________.
(2)pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为________.
(3)已知AnBm的离子积=[c(Am+)]n· [c(Bn-)]m,式中c(Am+)、c(Bn-)表示离子的物质的量浓度.在某温度下,Ca(OH)2的溶解度为0.74g,设饱和溶液密度为1g/ mL,其离子积为________.
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
在某温度下,重水(D2O)的离子积常数为1×10-12.若用pH一样的定义来规定pD值,则pD=-lg{c(D+)}.该温度下:
(1)纯重水的pD=________.
(2)1L溶有0.01 mol NaOD的D2O溶液,其pD=________.
(3)100 mL 0.1 mol/L的D2SO4溶液与100 mL 0.4 mol/L的KOD的D2O溶液混合,pD=________.
查看答案和解析>>
科目: 来源: 题型:022
已知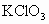 (氯酸钾)在发生分解反应时会释放出
(氯酸钾)在发生分解反应时会释放出 并生成KCl,但反应速率较低。
并生成KCl,但反应速率较低。
(1)你设想一下,有哪些条件可能提高 的分解反应速率?
的分解反应速率?
(2)写出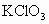 分解反应的化学方程式。
分解反应的化学方程式。
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
一定温度下,由水电离的H+和OH-的物质的量浓度之间存在着如下关系:
c(H+)·c(OH-)=KW.同样,对于难溶盐MA,其饱和溶液的M+和A-的物质的量浓度之间也存在类似关系:c(M+)·c(A-)=K(常数).现将足量的AgCl分别放在5 mL水,10 mL 0.2 mol/L MgCl2,20 mL 0.5 mol/L NaCl和40 mL 0.3 mol/L盐酸中溶液达到饱和,各溶液中Ag+离子的物质的量浓度的数值依次为a、b、c、d,它们由大到小的排列顺序为________.
查看答案和解析>>
科目: 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
有一实验①如图所示,将30 mL 0.1 mol/L Ba(OH)2溶液置于烧杯中,然后边搅拌边慢慢加入0.1 mol/L某第3周期元素形成的某酸溶液共25 mL,加入酸溶液的体积V和电流强度I的I-V图如图②所示.
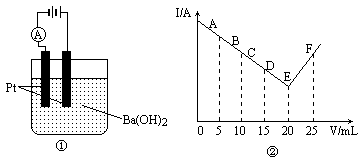
(1)此酸的化学式为________.
(2)处于C点时,溶液中导电的阳离子主要是________.
(3)处于F点时,溶液中导电的阴离子主要是________.
(4)烧杯中刚加入酸时,观察到的现象是________.
(5)图②中,从A→E电流强度I变小的主要原因是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com