
科目: 来源: 题型:022
某化学课外小组所做实验的示意图如附图所示:
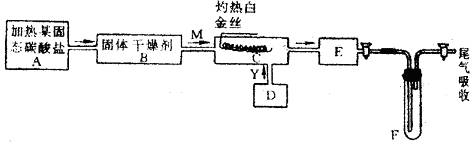
图中“→”表示气体流向,M是一种纯净而干燥的气体,Y是另一种气体,E内有棕色气体产生。实验所用的物质,只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。
据此实验,完成下列填空:
(1)A中所用装置的主要仪器有 。
(2)B中所选的干燥剂是 ,其作用是 。
(3)C中发生的主要反应的化学方程式是
(4)制取Y气的D装置所用的主要仪器是 ,制取Y气的化学方程式是 。
(5)当F中充有一定量气体后,D停止送气,A停止加热,并立即关闭两个活塞,这时若将F浸入冰水中,可看到F中的现象是
,其原因是
。
查看答案和解析>>
科目: 来源: 题型:022
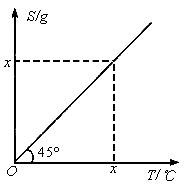
某物质溶解度曲线如图所示。现有该物质A、B两种不同浓度的不饱和溶液,当A冷却至10℃时有晶体析出,B在60℃时成为饱和溶液。若取10℃时A的100g饱和溶液,取60℃时B的50g饱和溶液混合得C溶液,则需降温到多少度(℃)时才能析出5g无水晶体?
查看答案和解析>>
科目: 来源: 题型:022
在120℃时分别进行如下四个反应:
A.2H2S+O2=2H2O+2S B.2H2S+3O2=2H2O+2SO2
C.C2H4+2O2=2H2+2CO2 D.C4H8O2+5O2=4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前<d后和p前<p后的是 ;符合关系式d前>d后和p前>p后的是 (请填写反应的代号)。
(2)若反应在压强恒定容器可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前=d后和V前>V 后的是 ;符合关系式d前=d后和V前<V后 的是 (请填写反应的代号)。
查看答案和解析>>
科目: 来源: 题型:022
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。下面是某些短周期元素的x值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.25 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)推测在同周期或同主族的元素中x值与原子半径的关系是________。根据短周期元素的x值变化特点,体现了元素性质的________变化规律。
(2)通过分析x值变化规律,确定Mg、N的x值范围:________<x(Mg)<________,________<x(N)<________。
(3)在P-N键中,共用电子对偏向________原子;
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Dx)即Dx>1.7时,一般为离子键,Dx<1.7,一般为共价键,试推断:AlBr3中化学键类型是________。
(5)推测元素周期表中,x值最大的元素是________。
查看答案和解析>>
科目: 来源: 题型:022
大气中污染气体之一SO2,可用如下方法测定其含量,将含有SO2的空气通过酸化KMnO4溶液,使![]() 氧化为SO
氧化为SO![]() 。现有500L空气,其密度为1.2g·L-1。通过
。现有500L空气,其密度为1.2g·L-1。通过![]() 溶液后有1.50×10-5mol KMnO4被还原为Mn2+。配平该反应的离子方程式并计算空气中SO2的质量百分含量。
溶液后有1.50×10-5mol KMnO4被还原为Mn2+。配平该反应的离子方程式并计算空气中SO2的质量百分含量。
□MnO![]() +□
+□![]() +□ ==
□Mn2++□SO
+□ ==
□Mn2++□SO![]() +□H+
+□H+
查看答案和解析>>
科目: 来源: 题型:022
某厂得知市场急需无水氯化镁,而工厂仓库有大量MgO、NH4Cl、MnO2和盐酸及焦炭,于是技术员设计了两种利用库存原料制取MgCl2的工艺,这两种工艺的原理分别是:①________;②________。这两种工艺中________最好,理由是_____________。
查看答案和解析>>
科目: 来源: 题型:022
为了除去工业废气中的SO2,某化工厂采用下列措施,将经过初步处理的含有0.2%的SO2和10%的O2(均为体积分数)的废气,在400℃时,废气以5m3/h的速度通过V2O5催化剂后与20L/h速度的NH3混合再喷水,此时气体温度由800℃降至200℃,在热的结晶装置中得到(NH4)2SO4晶体(气体体积均已折算成标准状况),仔细阅读上文回答下列问题:
(1)按反应理论值,SO2与O2的物质的量之比为2∶1,经过初步处理的废气中SO2与O2物质的量之比为________,采用这种比值的原因是________________________________;
(2)通过计算说明,为什么废气以5m3/h的速度与20L/h速度的NH3混合?
查看答案和解析>>
科目: 来源: 题型:022
在周期表中,同一主族元素化学性质相似.目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则.据此请回答:
(1)锂在空气中燃烧,除生成________外,也生成微量的________.
(2)铍的最高价氧化物的水化物的化学式是________,属两性化合物,证明这一结论的有关离子方程为________.
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为________________________.
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
用电子式表示BeCl2的形成过程________.
查看答案和解析>>
科目: 来源: 题型:022
有一种多聚硼酸盐为无限网状结构,下图为其结构单元示意图.其结构的基本单元可表示为(![]() )m-.则m=________,n=________.
)m-.则m=________,n=________.

多聚硼酸盐的网状结构单元示意图
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com