
科目: 来源: 题型:022
H2S与浓HNO3溶液反应,当HNO3过量时,H2S的氧化产物是 H2SO4,HNO3的还原产物是NO,完成并配平这一反应的化学方程式_____________________________; 如果反应中有2.4mol电子转移时,生成的NO在标准状况下的体积是_______L,将这些NO全部氧化并被水完全吸收,需标准状况下的O2__________L。
查看答案和解析>>
科目: 来源: 题型:022
完成并配平下列化学方程式(填入系数或化合物的分子式):
![]() (1)□KI +□ KIO3
+ □H2SO4==□K2SO4 +□ I2+□
(1)□KI +□ KIO3
+ □H2SO4==□K2SO4 +□ I2+□
![]()
![]() (2)□KMnO4
+□Na2C2O4 +□ □K2SO4
+□Na2SO4 +□CO2↑+ □MnSO4 +□H2O
(2)□KMnO4
+□Na2C2O4 +□ □K2SO4
+□Na2SO4 +□CO2↑+ □MnSO4 +□H2O
查看答案和解析>>
科目: 来源: 题型:022
如果化肥厂用NH3制备NH4NO3,已知由NH3制备NO的产率为96%,NO制硝酸的产率为92%,硝酸跟NH3反应生成NH4NO3,则制备HNO3所用去的NH3的质量占总消耗NH3的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:022
在25℃,101kPa条件下,将15L氧气通入10L一氧化碳和氢气的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原
![]() 和
和 ![]() 的混合气中
的混合气中![]() ________L,
________L,
![]() ____________L。
____________L。
(2)若剩余气体的体积是
![]() L,则原
L,则原 ![]() 和
和 ![]() 的混合气中
的混合气中![]() ______。
______。
(3)若剩余气体的体积为
![]() L,则
L,则 ![]() 的取值范围是_______。
的取值范围是_______。
查看答案和解析>>
科目: 来源: 题型:022
某工业废水里含游离氯0.04 mol•L-1,氢离子浓度为0.001 mol•L-1,废水排放速率10•s-1,为了变成无游离氯的中性水,在废水排出管的A、B处,分别注入0.1 mol•L-1 NaOH溶液和0.2 mol•L-1 Na2SO3溶液。
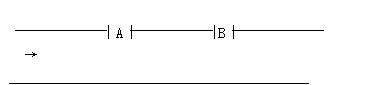
(1)在A、B处各应注入何种溶液?为什么?
(2)两种液体的流量应控制多大?
查看答案和解析>>
科目: 来源: 题型:022
为降低硫的氧化物对空气的污染,可以将氧化钙和含硫的煤混合后燃烧(这种方法叫钙基固硫)。请写出钙基固硫的反应方程式,并讨论(从反应热的角度)使用氧化钙和碳酸钙的区别。
查看答案和解析>>
科目: 来源: 题型:022
硫可用于制造黑火药、焰火、火柴等。其中黑火药的成分是硝酸钾、木炭粉、硫磺。当加热或点燃时会发生剧烈反应易爆炸。产生硝烟及大量气体。
(1)写出该反应的化学方程式:____________________________________。
(2)禁止燃放烟花爆竹的原因是防止环境污染,其中主要的污染是 ( )
A.水污染 B.大气污染 C.噪声污染 D.食品污染 E. 土壤污染
(3)如果将黑色火药分离,方法是首先将黑色火药加 ,过滤、蒸发滤液得 ,再将滤渣用 溶解,过滤之后蒸发得 固体,最后在 上还剩有 。
查看答案和解析>>
科目: 来源: 题型:022
测定海水中溶解氧的步骤如下:
①水样的固定:取a mL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡均匀,使之充分反应。
②酸化:开塞后迅速加适量1∶1硫酸,再迅速塞好瓶塞,反复振荡至沉淀完全溶解。
③滴定:向溶液中加入1 mL 0.5%的淀粉溶液,再用b mol•L-1 Na2S2O3标准溶液滴定至溶液刚好褪色。
有关的离子反应如下:
2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I![]() +2S
+2S![]() O
O![]() =2I-+S
=2I-+S![]() O
O![]()
请回答下列问题:
(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果 (填偏高、偏低或无影响),原因是 。
(2)滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果 (填偏高、偏低或无影响),原因是 。
(3)滴定前,未排除滴定管中的气泡,在滴定过程中气泡排除,会使测定结果 (填偏高、偏低或无影响),原因是 。
(4)滴定时消耗了V mL Na2S2O3标准溶液,则水中溶解O2(g/L)的量的计算式为 。
查看答案和解析>>
科目: 来源: 题型:022
我国规定饮用水质量标准必须符合下列要求:
|
pH |
6.5~8.5 |
|
Ca2+、Mg2+总浓度 |
<0.0045 mol•L-1 |
|
细菌总数 |
<100 个/mL |
以下是源水处理成自来水的工艺流程示意图

(1)源水中含Ca2+、Mg2+、HCO![]() 、Cl-等,加入石灰后生成Ca(OH)
、Cl-等,加入石灰后生成Ca(OH)![]() ,进而发生若干复分解反应,写出其中一个离子方程式
。
,进而发生若干复分解反应,写出其中一个离子方程式
。
(2)凝聚剂除去悬浮固体颗粒的过程 。
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4•7H2O是常用的凝聚剂,它在水中最终生成 沉淀。
(3)通入二氧化碳的目的是 和 。
(4)气体A的作用是 。这种作用是基于气体A和水反应的产物具有 性。
(5)下列物质中, 可以作为气体A的代用品。
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com