
科目: 来源: 题型:022
有甲、乙两瓶无色溶液,已知它们只可能是AlCl3溶液和NaOH溶液。现做如下实验:
①取440 mL甲溶液与120 mL 乙溶液反应产生1.56 g沉淀;
②或取120 mL 甲溶液与440 mL乙溶液反应也产生1.56 g沉淀;
③若取120 mL甲溶液与400 mL乙溶液反应,则产生3.12 g沉淀。
试通过计算和推理判断:
甲溶液为 溶液,甲溶液的物质的量浓度为 ;乙溶液的物质的量浓度为 .
查看答案和解析>>
科目: 来源: 题型:022
利用工厂的镁铝和稀硫酸、稀盐酸和NaOH溶液制取MgCl2和Al2(SO4)3,要求操作步骤简单,发生反应少,按操作步骤依次写出操作要点和反应的化学方程式。
查看答案和解析>>
科目: 来源: 题型:022
⑴在烧制砖瓦时,用粘土做成的坯经过烘烧,铁的化合物转化成 而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的 气体,它们把该红色物质还原成黑色的化合物是 ,同时还有未烧的碳的颗粒,而制得了青色砖瓦。
⑵已知工业上冶炼铷的反应方程式为:2RbCl+Mg![]() MgCl2+2Rb(g)
MgCl2+2Rb(g)
试回答下列有关问题:
①冶炼中应选择的条件是 (填序号)
A. 空气条件 B. 氮气条件 C. 真空条件
②这一反应能进行的原因是
查看答案和解析>>
科目: 来源: 题型:022
铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH![]() 。请分析图,回答有关问题。
。请分析图,回答有关问题。

⑴假设有任何气体产生的曲线段内只有一种还原产物,试配平由b点到c点时反应的化学方程式。
Fe+ HNO3== Fe(NO3)3+ + H2O
⑵从O点到a点时的还原产物应为 。
⑶a点到b点时产生还原产物为 其原因是 。
⑷已知到达d点时,反应完全结束,此时溶液中的主要阳离子为 ,投入金属铁的物质的量之比![]() =
。
=
。
查看答案和解析>>
科目: 来源: 题型:022
自然界矿物质财富重晶石的主要成分是硫酸钡,它不溶于水,也不溶于任何一种酸和碱,纯净的硫酸钡可供医疗等方面应用。某课外活动小组的同学用重晶石矿和焦炭为原料制取纯净的硫酸钡,部分流程如框图所示(假设矿物中杂质不与焦炭反应):
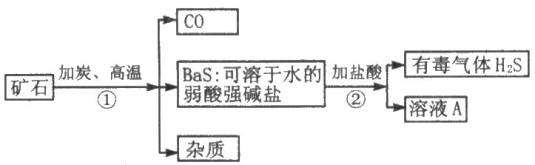
请按要求填空:
⑴在步骤①中化合价升高的元素为 ,化合价降低的元素为 ,溶液A的溶质的化学式为 。
⑵用溶液A制取Ba(OH)2的化学方程式为 。
⑶某同学指出:上述步骤②产生了有毒气体硫化氢,应将方法改进。请你写出改进意见,使该实验不产生硫化氢气体,又能获得纯净的硫酸钡,并请写出有关的化学方程式
。
查看答案和解析>>
科目: 来源: 题型:022
磷酸镁铵(NH4MgPO4)是一种重要的盐,难溶于水。化学上制备磷酸镁铵从反应原理看,是用氯化镁、磷酸氢二钠和氨水混合反应的方法。
⑴写出制备磷酸镁铵反应的离子方程式:
⑵在实际制备的反应中,要向混合液中加入适量的铵盐(NH![]() ),则加入铵盐的目的是
),则加入铵盐的目的是
查看答案和解析>>
科目: 来源: 题型:022
为测定钢铁中硫的含量,称取0.5000g试样,高温下在氧气流中燃烧,使试样中的硫转化为SO2。将燃烧后的气体通入1%的淀粉溶液中进行吸收,并用标准碘溶液进行滴定。
(1)滴定过程中反应的化学方程式是______________________________________,达终点时溶液呈________色;
(2)若达滴定终点时,消耗VmL物质的量浓度为a mol/L的碘溶液,则试样中硫的质量分数的计算式为________;
(3)为了快速得出测定结果,配制标准碘溶液时,要使每消耗0.1mL碘溶液相当于试样中含硫0.001%,则标准碘溶液的物质的量浓度应是________。
查看答案和解析>>
科目: 来源: 题型:022
100.0g无水氢氧化钾溶于100.0g水。在T温度下电解该溶液,电流强度I=6.00A,电解时间10.00h。电解结束温度重新调至T,分离析出的KOH×2H2O固体后,测得剩余溶液的总质量为164.8g。已知不同温度下每100g氢氧化钾饱和溶液中氢氧化钾的质量为:
|
温度/℃ |
0 |
10 |
20 |
30 |
|
KOH/g |
49.2 |
50.8 |
52.8 |
55.8 |
(已知电子的电量为1.6´10-19C,最后结果要求保留三位有效数字)
(1)被电解的水的物质的量为________mol;
(2)计算电解后剩余溶液的质量分数;(写出计算过程)
(3)温度T为________。
查看答案和解析>>
科目: 来源: 题型:022
某厂得知市场急需无水氯化镁,而工厂仓库有大量MgO、NH4Cl、MnO2和盐酸及焦炭,于是技术员设计了两种利用库存原料制取MgCl2的工艺,这两种工艺的原理分别是:①________;②________。这两种工艺中________最好,理由是_____________。
查看答案和解析>>
科目: 来源: 题型:022
为了除去工业废气中的SO2,某化工厂采用下列措施,将经过初步处理的含有0.2%的SO2和10%的O2(均为体积分数)的废气,在400℃时,废气以5m3/h的速度通过V2O5催化剂后与20L/h速度的NH3混合再喷水,此时气体温度由800℃降至200℃,在热的结晶装置中得到(NH4)2SO4晶体(气体体积均已折算成标准状况),仔细阅读上文回答下列问题:
(1)按反应理论值,SO2与O2的物质的量之比为2∶1,经过初步处理的废气中SO2与O2物质的量之比为________,采用这种比值的原因是________________________________;
(2)通过计算说明,为什么废气以5m3/h的速度与20L/h速度的NH3混合?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com