
科目: 来源: 题型:022
(2001年全国高考题)已知Fe2O3在高炉中有下列反应:Fe2O3+CO2→FeO+ CO2,反应形成的固体混合物(含Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe)∶ m(O)表示。
(1)上述固体混合物中,m(Fe)∶m(O)不可能是________(选填a、b、c,多选 扣1分)。
( )
A. 21∶9 b. 21∶7.5 c. 2l∶6
(2)若m(Fe)∶m(O)=21∶8,计算Fe2O3被CO还原的百分率。
(3)设Fe2O3被CO还原的百分率为A%,则A%和混合物中m(Fe)∶m(O)的关系式为〔用含m(Fe)、m(O)的代数式 表示〕A%=________。
请在下图中画出A%和m(Fe)∶m(O)关系的图形。

(4)如果Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2试分析反应形成的固体混合物可能的组成及相应的m(Fe)
∶m(O)〔令m(Fe)∶m(O)=21∶a,写出d的取值范围〕。将结果填入下表。
|
混合物组成(用化学式表示) |
a的取值范围 |
|
|
|
|
|
|
|
|
|
查看答案和解析>>
科目: 来源: 题型:022
某化工厂排出的废水含Cl2为0.014mo1·L-1、H+为0.001mo1·L-1,废水排 出的速度为10.0mL·s-1。为了除去此废水中的游离氯,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱液(0.10mo1·L-1)和Na2SO4溶液(0.10mo1·L-1)。

试回答:
(1)A处应注入________溶液,离子方程式为________;B处应注入________溶液,离子方程 式为_________。
(2)A处溶液的流量和B处溶液的流量分别应控制为多少(mL·s-1)?
查看答案和解析>>
科目: 来源: 题型:022
用氯氧化法处理CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含有KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应(其中N为-3价):KCN+2KOH+Cl2→KCNO+2KCl+H2O被氧化的元素是________。
(2)投入过量液氯,可将氰酸盐进一步氧化成为氮气。请配平下列化学方程式,并标出电子转移方向和数目:________。KCNO+KOH+Cl2—CO2+N2+KCl+H2O
(3)若处理上述废水20L,使KCN完全氧化转化为无毒物质,至少需液氯________g。
查看答案和解析>>
科目: 来源: 题型:022
在热的稀硫酸溶液中溶解了11.4gFeSO4。当加入50mL0.5mo1·L-1KNO3溶液后,使其中的Fe2+全部氧化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
□FeSO4+□KNO3=□H2SO4→□k2SO4+□Fe2(SO4)3+□NxOy+□H2O
(1)推算出x=________,y=________。
(2)配平上述化学方程式,标出电子转移的方向和数目。
(3)反应中的氧化剂是________。
查看答案和解析>>
科目: 来源: 题型:022
(重组提高)如图,甲、乙两室中分别装有淀粉溶液和水。
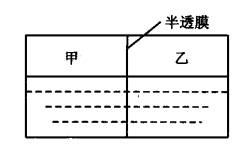
(1)若甲、乙室中装入的液体体积相同,对实验开始时的叙述正确的是( )
A. 水分子从甲室向乙室的扩散速度大于乙室向甲室的扩散速度
B. 水分子从乙室向甲室的扩散速度大于甲室向乙室的扩散速度
C. 两室中水分子的扩散速度相同
D. 两室中水分子的扩散速度将越来越小
(2)对于实验进行足够长时间后的情况预测正确的是( )
A. 最终两室水分子的相互扩散速度可以相等
B. 甲室中淀粉溶液的浓度始终不变
C. 甲室中淀粉溶液的体积将变大,乙室中水的体积将变小
D. 最终扩散将停止
查看答案和解析>>
科目: 来源: 题型:022
将6 mol H2与3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2H2(g)+CO(g)
![]() CH3OH(g),6 s时反应达到平衡,此时容器内压强为开始的0.6倍,则H2的平均反应速率为_________,CO的转化率为_________。
CH3OH(g),6 s时反应达到平衡,此时容器内压强为开始的0.6倍,则H2的平均反应速率为_________,CO的转化率为_________。
查看答案和解析>>
科目: 来源: 题型:022
常温常压下,A、B、C、D均为气体。A与B可发生可逆反应:A+B![]() C+nD。若将2molA和2molB混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
C+nD。若将2molA和2molB混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
|
温度 |
压强/(Pa) |
C平衡浓度/(mol·L-1) |
|
25℃ |
1 |
1.0 |
|
25℃ |
2 |
1.8 |
|
25℃ |
4 |
3.2 |
|
25℃ |
5 |
6.0 |
⑴该可逆反应中化学计量数n的取值范围为 ,理由是 。
⑵在5![]() 105Pa时,D的状态为 。
105Pa时,D的状态为 。
查看答案和解析>>
科目: 来源: 题型:022
一定条件下,把3 mol N2和3 mol H2通入一个一定容积的密闭容器中,发生反应:
N2(g)+3H2(g)![]() 2NH3(g)达到平衡时,NH3的浓度为w mol/L,N2的转化率为m,则:
2NH3(g)达到平衡时,NH3的浓度为w mol/L,N2的转化率为m,则:
(1)H2的转化率_________m(填“大于”“小于”“等于”或“无法确定”)。
(2)若在上述完全相同的容器中,维持温度不变,通入a mol NH3、b mol N2和c mol H2,要使达到平衡时,NH3的浓度仍为w mol/L。
若a=1,则b=_________,c=_________;b的取值范围为_______________。
(3)达到平衡时,H2和NH3均为1.5 mol,你认为是否可能?_________(填“可能”“不可能”或“无法确定”)。
查看答案和解析>>
科目: 来源: 题型:022
如图所示,有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两只容器中分别充入等量的体积比为2∶1的SO2与O2的混合气体,并使A和B容积相等(如图)。在保持400℃的条件下使之发生如下反应:2SO2+O2![]() 2SO3,填写下列空格。
2SO3,填写下列空格。
(1)达到平衡时所需的时间A容器比B容器___________,A容器中SO2的转化率比B容器_____________。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡_____________移动,B容器化学平衡___________移动。
(3)达到(1)所述平衡时,若向两容器中通入等量的原反应气体,达到平衡时,A容器中SO3的体积分数比原平衡_____________(增大、减小、不变);B容器中SO3的体积分数比原容器_____________(增大、减小、不变)。

查看答案和解析>>
科目: 来源: 题型:022
一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式:XY2(1)+3O2(g)=XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积为72mL,密度是2.56 g·L-1,则:
(1)反应前的O2的体积是(标准状况)________。
(2)化合物XY2的相对分子质量是________。
(3)若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为________和
________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com