
科目: 来源:物理教研室 题型:022
①取440 mL甲溶液与120 mL 乙溶液反应产生1.56 g沉淀;
②或取120 mL 甲溶液与440 mL乙溶液反应也产生1.56 g沉淀;
③若取120 mL甲溶液与400 mL乙溶液反应,则产生3.12 g沉淀。
试通过计算和推理判断:
甲溶液为 溶液,甲溶液的物质的量浓度为 ;乙溶液的物质的量浓度为 .
查看答案和解析>>
科目: 来源:物理教研室 题型:022
⑴将固体明矾用水溶解,加入过量的氨水,并过滤洗涤沉淀。加过去时量氨水的目的是 ;洗涤沉淀的目的是 ;
⑵取沉淀加 直到沉淀完全溶解,再蒸发、结晶得
⑶取⑴的滤液,加稍过量的 溶液并加热,其目的是 。再加少量 中和多余的碱。
⑷对⑶所得的溶液加热、浓缩、结晶得 。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
查看答案和解析>>
科目: 来源:物理教研室 题型:022
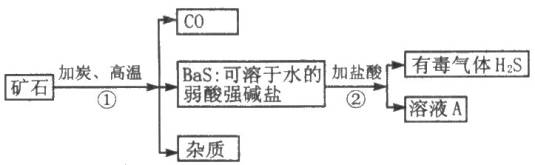
请按要求填空:
⑴在步骤①中化合价升高的元素为 ,化合价降低的元素为 ,溶液A的溶质的化学式为 。
⑵用溶液A制取Ba(OH)2的化学方程式为 。
⑶某同学指出:上述步骤②产生了有毒气体硫化氢,应将方法改进。请你写出改进意见,使该实验不产生硫化氢气体,又能获得纯净的硫酸钡,并请写出有关的化学方程式
。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
⑴写出制备磷酸镁铵反应的离子方程式:
⑵在实际制备的反应中,要向混合液中加入适量的铵盐(NH![]() ),则加入铵盐的目的是
),则加入铵盐的目的是
查看答案和解析>>
科目: 来源:物理教研室 题型:022
|
温度/℃ |
0 |
10 |
20 |
30 |
|
KOH/g |
49.2 |
50.8 |
52.8 |
55.8 |
(已知电子的电量为1.6´10-19C,最后结果要求保留三位有效数字)
(1)被电解的水的物质的量为________mol;
(2)计算电解后剩余溶液的质量分数;(写出计算过程)
(3)温度T为________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)滴定过程中反应的化学方程式是______________________________________,达终点时溶液呈________色;
(2)若达滴定终点时,消耗VmL物质的量浓度为a mol/L的碘溶液,则试样中硫的质量分数的计算式为________;
(3)为了快速得出测定结果,配制标准碘溶液时,要使每消耗0.1mL碘溶液相当于试样中含硫0.001%,则标准碘溶液的物质的量浓度应是________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)按反应理论值,SO2与O2的物质的量之比为2∶1,经过初步处理的废气中SO2与O2物质的量之比为________,采用这种比值的原因是________________________________;
(2)通过计算说明,为什么废气以5m3/h的速度与20L/h速度的NH3混合?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com