
科目: 来源: 题型:022
在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g)ƒ2HBr(g),已知加入1mol H2和2mol Br2时,达到平衡后生成amol HBr(见下表“已知”项),在相同条件下,仍保持平衡时各组分的体积分数不变,对下列编号①~③的状态,填写表中的空白。
编号 起始状态/mol 平衡时n(NBr)/mol
H2 Br2 HBr HBr
已知 1 2 0 a
① 2 4 0
② 1 0.5a
③ m n(n³2m)
查看答案和解析>>
科目: 来源: 题型:022
在某条件下,容器中有如下平衡反应:
A+4Bƒ2C+D;DH<0,此时,A、B、C的物质的量均为amol,而D的物质的量为dmol。改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在![]() 到2d之间变化,则a的取值范围应是________(用a和d的关系式表示)。
到2d之间变化,则a的取值范围应是________(用a和d的关系式表示)。
查看答案和解析>>
科目: 来源: 题型:022
如图所示,在烧杯A中盛有20℃,50mL水,B中盛有1mol×L-1盐酸50mL,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2ƒN2O4(DH<0放热)。当向A中加入50g硝酸铵使其溶解,往B中加入2g苛性钠,也使其溶解时,问:
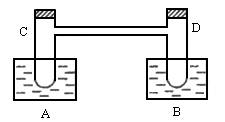
(1)A、B的烧杯中,A杯溶液温度________,B杯溶液温度________。
(2)A杯中溶液的pH________7,B杯中溶液的pH________7。
(3)试管C中气体颜色变________,D中气体颜色变________。
(4)在20℃时,硝酸铵的溶解度为197g,则推知:A中的溶液________达饱和。
(5)烧杯B中,全部物质完全反应后,理论上可放热应大于________kJ。
查看答案和解析>>
科目: 来源: 题型:022
汽油不完全燃烧的化学方程式为2C8H18+23O2→12CO2+4CO+18H2O,人体吸进CO后,CO、O2与人体血红蛋白(Hem)建立如下平衡:CO+Hem×O2ƒO2+Hem×CO,此平衡存在以下关系:
![]()
当Hem×CO浓度为Hem×O2浓度的2%时,人的智力将受到严重损伤。
某40万的中等城市,能有效利用标准状况下的空气为2.24´106m3(O2占体积的21%),以每辆汽车满负荷行驶每天约有28.5g汽油不完全燃烧,此城市每10人中有一辆汽车,试回答:
(1)该城市能有效利用的空气中含O2________mol。
(2)c(CO)/c(O2)£________时,人才能不受严重损伤。
(3)若该城市上方的未被污染的空气在某一天内没有流动,则该天汽车的最高使用率应不得超过________%。
查看答案和解析>>
科目: 来源: 题型:022
若A、B、C的起始浓度分别用amol×L-1、bmol×L-1、cmol×L-1表示,且a、b、c均不为0。在一定条件下,可逆反应A(g)+B(g)ƒ2C(g)达到平衡,c(A)=0.5mol×L-1,c(B)=0.1mol×L-1,c(C)=1.6mol×L-1。则:
(1)a、b应满足的关系是________。
(2)a的取值是________。
查看答案和解析>>
科目: 来源: 题型:022
(2003·江苏)Ⅰ.在恒温、恒压下,有一个可变容积的容器中发生如下反应:
A(g)+B(g)ƒC(g)
(1)若开始时放入1mol A和1mol B。到达平衡后,生成amol C,这时A的物质的量为________mol。
(2)若开始时放入3mol A和3mol B,到达平衡后,生成C的物质的量为________mol。
(3)若开始时放入xmol A、2mol B和1mol C,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=________mol,y=________mol。平衡时,B的物质的量________(选填一个编号)。
甲.大于2mol
乙.等于2mol
丙.小于2mol
丁.可能大于、等于或小于2mol作此判断的理由是________。
(4)若在(3)的平衡混合物中再加入3mol C待再次到达平衡后,C的物质的量分数是________。
Ⅱ.若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1mol A和1mol B到达平衡后生成bmol C。将b与(1)小题中的。进行比较________(选填一个编号)。
甲.a<b
乙.a>b
丙.a=b
丁.不能比较a和b的大小
作出此判断的理由是________。
查看答案和解析>>
科目: 来源: 题型:022
在化工分析中常用到滴定度这个概念,所谓滴定度是指每毫升滴定剂标准溶液相当于被测组分的质量,其单位为g×mL-1,现有一不溶于水的氧化亚铜样品,该样品能溶于用H2SO4酸化了的Fe2(SO4)3溶液中,所发生的反应可用化学方程式表示为2KMnO4+8H2SO4+10FeSO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O。若每升滴定剂溶液中含0.400mol KMnO4,求该KMnO4溶液对Cu2O滴定度。
NO是常见的大气污染物,它可以和血液中的血红蛋白结合,其亲和力比CO与血红蛋白的亲和力要大数百倍。
(1)汽车尾气中NO气体的来源是什么?
(2)NO使人中毒的根本原因是什么?
(3)目前治理NO污染的方法之一是:在400℃左右和有催化剂的情况下,用氨把NO还原为氮气和水,写出其化学方程式。
(4)根据国家环保局的统一规定,目前许多大城市进行常规大气监测的项目是:二氧化硫、氮氧化合物、悬浮颗粒物等三种大气污染物。简述城市空气质量预报对有关部门和普通市民有什么指导意义。
查看答案和解析>>
科目: 来源: 题型:022
把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸易被空气中的O2氧化为I2。I2在水溶液中可与红磷反应生成PI3,PI3水解生成HI和H3PO3。
(1)写出氢碘酸氧化变质的离子方程式________。
(2)________(填“能”或“不能”)用浓硫酸与固体NaI共热制HI,原因是________。
(3)在配制的氢碘酸溶液中,加少量的红磷,在露置于空气的过程中,若溶液的体积不变,则配制溶液中HI的物质的量浓度是________(填“会变化”或“不变”)。写出加入红磷后可能发生反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:022
已知1 mol CuSCN在下列反应中失去7mol电子,完成并配平下列化学方程式:![]() CuSCN+
CuSCN+![]() KMnO4+
KMnO4+![]() H2SO4——
H2SO4——![]() HCN+
HCN+![]() CuSO4+
CuSO4+![]() MnSO4+
MnSO4+![]() K2SO4+
K2SO4+![]() H2O。
H2O。
查看答案和解析>>
科目: 来源: 题型:022
NO的生物性已引起科学家的高度重视。它与超氧离子(O-2)反应,该反应的产物本题用A代号表示。A被认为是人生病,如炎症、中风和心脏病、风湿病等引起大量细胞和组织毁坏的原因。A的巨噬细胞里的受控生成却是巨噬细胞能够杀死癌细胞和入侵微生物的重要原因,且A是NO3-的异构体,无环链结构。
(1)写出A的化学式。写出NO跟超氧离子的反应方程式。你认为A离子的可能结构是什么?试写出它的路易斯结构式(即用短横表示化学键和用小黑点表示未成键电子的结构式)。
(2)在常温下将NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力![]() 就不再改变,已知其中一种产物N2O,写出化学方程式,
就不再改变,已知其中一种产物N2O,写出化学方程式,
并解释略小于![]() 的原因。
的原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com